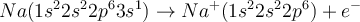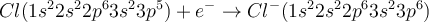Chemie 03 - Chemische Bindungen und Wechselwirkungen
Abschnittsübersicht
-
-
Chemische Bindungen
Solltest du dich bereits mit dem Automaufbau beschäftigt haben, hast du auch schon mal gehört, dass Atome aller Elemente (bis auf die der Edelgase) Verbindungen eingehen möchten. Kommt so eine Verbindung zustande, gibt es Veränderungen in der Elektronenverteilung. Und chemische Bindungen werden je nach Art der Elektronenverteilung unterschieden. Hier eine kleine Übersicht zu den verschiedenen Arten an chemischen Bindungen:
Es gibt zum einen die Ionenbindung, bei der die Elektronen von Atomen auf eine andere Sorte Atome übergehen. Dabei geben die Atome des reagierenden Elements Elektronen ab und werden so zu positiv geladenen Atomen, während die Atome des Reaktanden Elektronen aufnehmen und so zu negativ geladenen Ionen werden. Durch die elektrostatische Anziehung bleiben die positiv und negativ geladenen Ionen zusammen👩❤️👩.
Die kovalente Bindung ist für den festen Zusammenhalt 👬 von Atomen in chemischen Verbindungen zuständig und bildet sich vorwiegend zwischen Nichtmetallen aus. Die involvierten Atome teilen sich dabei Elektronenpaare (mindestens eins), wodurch die Atome zusammengehalten werden.
Die Metallbindung wirkt, wie der Name schon sagt, zwischen Metallen. Sie ist außerdem auch noch unter dem Begriff metallische Bindung bekannt. Da die meisten Atome der Metalle nur wenige Außenelektronen besitzen, werden diese abgegeben und können sich dann frei im Metallgitter bewegen und bilden dadurch das sogenannte Elektronengas. Dadurch entstehen typische metallische Eigenschaften wie zum Beispiel die elektrische Leitfähigkeit 🔌.
Die Wasserstoffbrückenbindung ist eine bindende Wechselwirkung, die aus einem gebundenen Wasserstoffatom eines Moleküls und einem stark elektronegativen Atom eines weiteren Moleküls hervorgeht. Meist ist das elektronegative Atom Sauerstoff, Stickstoff oder Fluor.
Bei den van-der-Waals-Kräften handelt es sich um Wechselwirkungen, die durch die Anziehung zwischen Dipolen zustande kommen. Es wird dabei zwischen drei Typen unterschieden: dem Richteffekt, dem Induktionseffekt und dem Dispersionseffekt.
So, jetzt hast du schon mal einen groben Überblick über chemische Bindungen. Keine Sorge, falls du dir noch nicht so viel gemerkt hast. Wir gehen ja erst im nächsten Abschnitt ins Detail 😄
-
Ionenbindung
Die Ionenbindung entsteht durch die Reaktion von einem Metall mit einem Nichtmetall. Aus dem Elektronenübergang vom Metall zum Nichtmetall resultieren geladene Teilchen, die sogenannten Ionen. Das Ganze sieht am Beispiel von Natrium und Chlor so aus:
Reaktion von Natrium mit Chlor
Natrium befindet sich in der ersten Hauptgruppe und besitzt deshalb ein Valenzelektron (dargestellt durch den Punkt oben rechts neben dem Na). Chlor steht in der siebten Hauptgruppe und verfügt über sieben Valenzelektronen (dargestellt durch die 3 Striche, wobei jeder Strich für 2 Elektronen steht und den Punkt oben rechts neben dem Cl). Bei der Reaktion zwischen Natrium und Chlor gibt das Natrium-Atom sein Valenzelektron ab und das Chlor-Atom nimmt es dann auf. Natrium hat jetzt ein Elektron verloren und hat deswegen nur noch 10, im Kern sind jedoch nach wie vor 11 Protonen enthalten. Dadurch besitzt das Natrium-Ion die Ladung 1+. Das Chlorid-Ion besitzt nun 18 Elektronen, aber immer noch nur 17 Protonen, weswegen es die Ladung 1- hat. Du kannst dir merken, dass die positiv geladenen Ionen als Kationen bezeichnet werden und die negativ geladenen Ionen als Anionen.
Da die Anzahl der vom Natrium abgegebenen Elektronen mit der Anzahl der vom Chlor aufgenommenen Elektronen übereinstimmt, sind die positiven Natrium-Ionen und die negativen Chlor-Ionen im Verhältnis 1:1 vorhanden. Die Ionen ordnen sich in einem sogenannten Ionen-Kristall an. (Falls du nicht weißt, was ein Kristallgitter ist, informiere dich hier darüber 😊).
Der nachfolgende Link führt zu einer externen Internetseite, die ggf. andere Datenschutzvorgaben erfüllt als wir es auf dieser Plattform tun. Dabei können Daten von dir übertragen und weiterverarbeitet werden. Wenn du dich allgemein zum Thema Datenschutz erkundigen möchtest, empfehlen wir dir die Erklärvideos der Initiative Datenschutz geht zur Schule.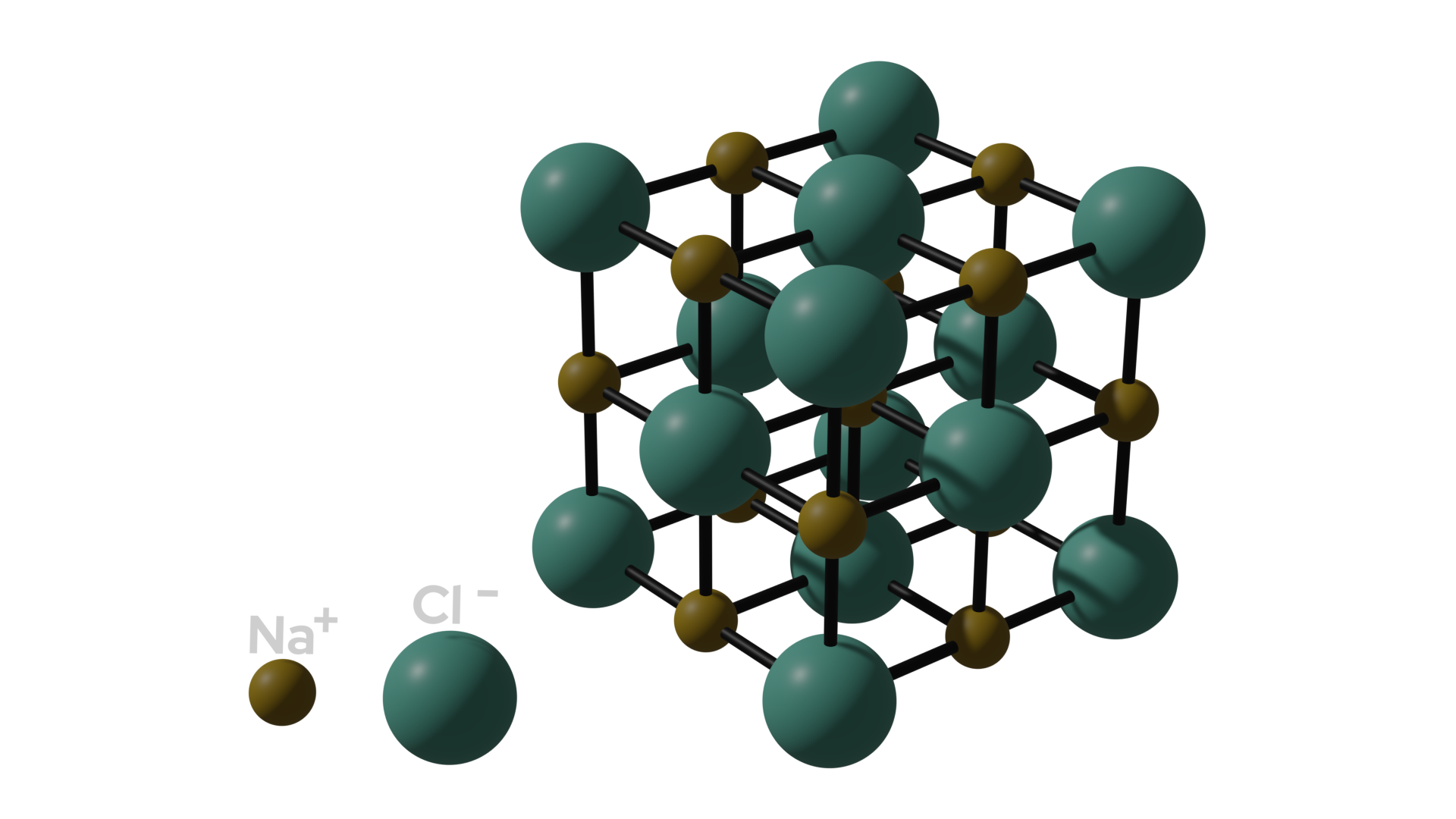
Kristallgitter von Natriumchlorid von Nick Donner Im dargestellten Natriumchlorid-Kristall gehört kein Ion nur zu einem anderen Ion. Tatsächlich ist es so, dass jedes Natrium-Ion von sechs Chlor-Ionen umgeben ist und jedes Chlor-Ion von sechs Natrium-Ionen. Die Zahl der umgebenden Ionen bzw. Nachbar-Ionen wird mittels der Koordinationszahl beschrieben. Diese ist in beiden Fällen sechs. Durch die entgegengesetzte Ladung der Nachbar-Ionen des Ions, überwiegen im Kristallgitter die Anziehungskräfte und nicht die abstoßenden Kräfte. Dadurch wird der Kristall zusammengehalten und das ist tatsächlich auch die Hauptcharakteristik der Ionenbindung.
Die Elektronenkonfiguration gibt die Verteilung der Elektronen in der Elektronenhülle eines Atoms für verschiedene Energiezustände und Aufenthaltsräume wie z.B. Orbitale an. Für die Beispielreaktion sieht die Elektronenkonfiguration wie folgt aus:Wenn du bereits mit dem Atomaufbau bzw. dem Orbitalmodell vertraut bist, solltest du die Elektronenkonfiguration "lesen" können. Natrium hat links noch 11 Elektronen aber nach der Reaktion sind es nur noch 10 Elektronen. Deswegen ist das Natrium-Ion positiv geladen und hat noch ein negativ geladenes abgespaltenes Elektron. Außerdem kannst du lesen wie viele Elektronen sich in welcher Schale befinden. Das Gleiche gilt auch für Chlor. Chlor hat 17 Elektronen und nimmt das freie Elektron von Natrium auf, wodurch das Chlor-Ion eine negative Ladung bekommt.
Natriumchlorid kennst du bestimmt schon aus der Küche. Es ist unser allseits beliebtes Kochsalz! Fast alle Verbindungen, die auf Ionenbindungen beruhen, sind Salze. Denn diese chemischen Verbindungen bestehen aus ➕ geladenen und ➖ geladenen Ionen. Bei anorganischen Salzen werden die Kationen meist von Metallen und die Anionen von Nicht-Metallen gebildet. Als organische Salze werden alle Verbindungen bezeichnet, bei denen mindestens ein Kation oder ein Anion eine organische Verbindung ist.
Jetzt sehen wir uns nochmal anhand von Natriumchlorid die sogenannte Verhältnisformel an. Natriumchlorid ist aus den Kationen Na+ und den Anionen Cl- aufgebaut. Es liegt also Natrium und Chlor im Verhältnis 1:1 vor und bei dieser Verhältnisformel ist das Besondere, dass sich die positiven und negativen Ladungen aufheben müssen. Tatsächlich ist es aber nicht immer ganz so einfach. Am Beispiel des Salzes Calciumchlorid (CaCl2) würdest du jetzt denken, dass es ja eigentlich gar kein 🧂 sein kann, weil die Kationen und Anionen sich nicht aufheben oder? Calcium ist aber ein zweiwertiges Kation. Calcium steht in der 2. Hauptgruppe im Periodensystem der Elemente (PSE) und muss deshalb zwei Elektronen abgeben, um die Oktettregel zu erfüllen. Dadurch entsteht das zweiwertige Calcium-Kation (Ca2+), welches also zweifach positiv geladen ist. Hier eine kleine Tabelle mit einigen Kationen und Anionen und den dazugehörigen Ladungen:
einwertige Kationen zweiwertige Kationen dreiwertige Kationen einwertige Anionen zweiwertige Anionen Kalium, K+ Calcium, Ca2+ Eisen(III), Fe3+ Fluoride, F- Oxide, O2- Natrium, Na+ Magnesium, Mg2+ Aluminium, Al3+ Chloride, Cl- Sulfide, S2- Ammonium, NH4+ Eisen(II), Fe2+ Bromide, Br- Iodide, I- 🧂🧂 haben auch die ein oder andere Besonderheit, die du vielleicht schon aus deinem Alltag kennst. Salze haben beispielsweise sehr hohe Schmelztemperaturen und sind außerdem ziemlich hart und spröde. Würdest du jetzt zu Hause große Stückchen Salz zerkleinern, könntest du recht glatte Bruchkanten erkennen. All diese Besonderheiten gehen auf das Ionengitter zurück. Salz ist aber auch löslich in Wasser, wie du bestimmt schon mal beim Nudeln kochen bemerkt hast 👩🍳. Das Wasser überwindet sozusagen die Gitterenergie des Ionengitters durch Hydratisierung. Hydratisierung ist die Anlagerung von Wassermolekülen an gelöste Ionen. Denn feste Bindung = fester Zusammenhelt = viel benötigte Energie, um das Gitter zu brechen. Diese Löslichkeit wird oft so dargestellt: NaCl(s) Na+(aq) + Cl-(aq) Hierbei
steht das s für solid, also für einen Feststoff und das aq steht für
aqua (Wasser) und zeigt an, dass der Stoff in Wasser löslich ist.
Salzschmelzen und wässrige Lösungen sind sogar in der Lage elektrischen
Strom aufgrund ihrer frei beweglichen Ionen als Ladungsträger zu leiten.
Cool, oder? 😎
Na+(aq) + Cl-(aq) Hierbei
steht das s für solid, also für einen Feststoff und das aq steht für
aqua (Wasser) und zeigt an, dass der Stoff in Wasser löslich ist.
Salzschmelzen und wässrige Lösungen sind sogar in der Lage elektrischen
Strom aufgrund ihrer frei beweglichen Ionen als Ladungsträger zu leiten.
Cool, oder? 😎 -
Kovalente Bindung
Die kovalente Bindung tritt zwischen Nichtmetallen auf, wobei hier keine Elektronenübertragung wie bei der Reaktion von Metallen mit Nichtmetallen auftritt, sondern die Atome sich über gemeinsame Elektronenpaare aneinanderbinden. Das Ziel ist aber trotzdem dasselbe: die Edelgaskonfiguration erreichen. Die kovalente Bindung kann in eine Einfachbindung, eine Doppelbindung und eine Dreifachbindung unterschieden werden.
Die 1️⃣-fachbindung besteht lediglich aus einem Elektronenpaar, welches sich von zwei Atomen geteilt wird. Die Doppelbindung (du kannst es dir bestimmt schon denken 😄) besteht aus zwei Elektronenpaaren, die sich geteilt werden und die 3️⃣-fachbindung dann aus drei geteilten Elektronenpaaren.
Genau wie bei der Ionenbindung wird die kovalente Bindung mit Hilfe einer bestimmten Formelschreibweise dargestellt, um diese und die Verteilung der Elektronen besser sichtbar zu machen. Dafür wird am besten die Elektronenformel und die Valenzstrichformel verwendet. Folgende Regeln zu den Schreibweisen solltest du dir merken:
- Ein einzelnes Valenzelektron wird mittels Punkt gekennzeichnet. Das hast du bereits bei der Ionenbindung von Natriumchlorid gesehen. Das ist die Schreibweise der Elektronenformel.
- Zwei Elektronen lassen sich zu einem Elektronenpaar verbinden mittels eines Strichs. Auch diese Darstellung war bei der Ionenbindung von Natriumchlorid zu sehen. Dabei handelt es sich um die Valenzstrichformel.
- Befindet sich ein Strich zwischen zwei Atomen, symbolisiert dieser die kovalente Bindung. Das wird auch als bindendes Elektronenpaar bezeichnet.
- Liegt ein Strich flach an einem Atom, wird ein einsames Elektronenpaar dargestellt, welches auch unter den Bezeichnungen freies bzw. nicht bindendes Elektronenpaar bekannt ist.
- Auch die Formelladung lässt sich darstellen, die Schreibweise ist dir längst bekannt. Denn wenn sich die Anzahl der Valenzelektronen nach der Reaktion von der Anzahl der Valenzelektronen vor der Reaktion unterscheiden, wird die Formelladung mit einem hochgestellten Plus- oder Minuszeichen angegeben.
In der nachfolgenden Abbildung sind die Formelschreibweisen nochmal anhand von chemischen Verbindungen exemplarisch dargestellt. 😊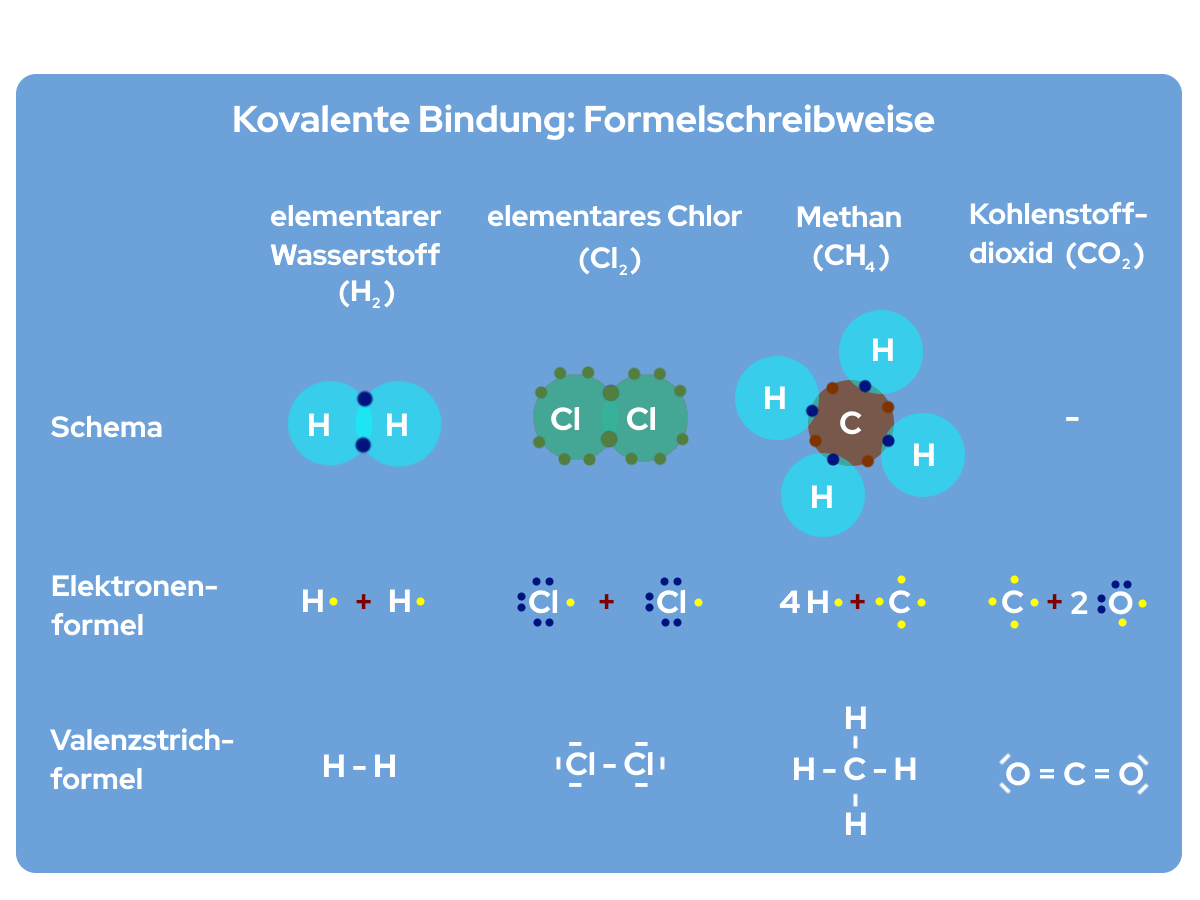
Formelschreibweise von Nick Donner Bei der kovalenten Bindung spielt es aber nicht nur eine Rolle wie viele Elektronenpaare sich geteilt werden, sondern auch die Elektronegativität ist relevant. Diese lässt sich für jedes Element aus dem Periodensystem ablesen. Die kovalente Bindung wird je nach Elektronegativität der Atome in unpolare und polare kovalente Atombindung unterschieden.
Ist die Elektronegativität beider Atome gleich und das Elektronenpaar wird zu gleichen Teilen geteilt, wird von einer unpolaren Atombindung gesprochen. Die Elektronegativitätsdifferenz zwischen den zwei Atomen beträgt dann
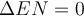 . Die unpolare Bindung kann
also nur zwischen Molekülen aus gleichen Atomen auftreten wie beispielsweise
bei Wasserstoff (H2). Ist
die Elektronegativitätsdifferenz beider Bindungspartner größer als null, also
. Die unpolare Bindung kann
also nur zwischen Molekülen aus gleichen Atomen auftreten wie beispielsweise
bei Wasserstoff (H2). Ist
die Elektronegativitätsdifferenz beider Bindungspartner größer als null, also
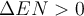 , handelt es sich um die polare Atombindung. Das Elektronenpaar
wird dadurch stärker von dem elektronegativen Atom angezogen. Das hat zur
Folge, dass die beteiligten Atome teilweise geladen sind. Das elektronegativere
Atom hat eine negative Partialladung
, handelt es sich um die polare Atombindung. Das Elektronenpaar
wird dadurch stärker von dem elektronegativen Atom angezogen. Das hat zur
Folge, dass die beteiligten Atome teilweise geladen sind. Das elektronegativere
Atom hat eine negative Partialladung 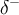 und das elektropositivere Atom
eine positive Partialladung
und das elektropositivere Atom
eine positive Partialladung 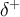 . Es gibt einen fließenden Übergang von der einfachen kovalenten Bindung über die polare kovalente Bindung zur Ionenbindung. Denn die Ionenbindung besitzt keine definierten Grenzen, da keine Elektronenpaare geteilt werden, sondern ein Elektron abgegeben oder aufgenommen wird, wodurch Ionen entstehen.
. Es gibt einen fließenden Übergang von der einfachen kovalenten Bindung über die polare kovalente Bindung zur Ionenbindung. Denn die Ionenbindung besitzt keine definierten Grenzen, da keine Elektronenpaare geteilt werden, sondern ein Elektron abgegeben oder aufgenommen wird, wodurch Ionen entstehen. -
Metallbindung
Die Metallbindung tritt, wie der Name schon verrät, bei Metallen auf. Aber auch in Legierungen, die aus einem Gemisch von mindestens einem Metall bestehen, kommt die metallische Bindung vor. Tatsächlich sind sogar in etwa 80 % aller Elemente im Periodensystem Metalle. Da diese Grenze aber unscharf verläuft, werden diese Grenzelemente als Halbmetalle bezeichnet. Also sind das ganz schön viele Möglichkeiten für das Vorkommen einer Metallbindung 😲
Da Metall-Atome relativ niedrige Ionisierungsenergien und Elektronegativitäten besitzen, geben sie ihre Außenelektronen recht schnell ab. Dadurch, dass die Valenzelektronen abgegeben werden, wird Elektronengas gebildet. Das Elektronengas kann dann allen involvierten Metall-Atomen dienlich sein, um die Elektronengaskonfiguration zu erlangen. Die im Elektronengas frei beweglichen Elektronen sorgen für die charakteristisch metallischen Eigenschaften wie elektrische Leitfähigkeit, metallischer Glanz und Verformbarkeit.
Genau wie bereits bei der Ionenbindung entstehen auch Metallbindungen durch Anziehungskräfte. Die Anziehungskräfte entstehen zwischen positiv geladenen Metall-Kationen bzw. Atomrümpfen und den negativ geladenen Elektronen der Metalle. Die negativen Elektronen umschließen die positiven Ionen, wodurch der Zusammenhalt in den Metallen entsteht. Um die Entstehung der Metallbindung detaillierter zu betrachten, werden zwei Modelle herangezogen. Einmal das Elektronengasmodell und einmal das Bändermodell.
Bei dem Elektronengasmodell werden, wie bereits oben erwähnt, die Valenzelektronen der Metall-Atome relativ schnell abgegeben, um die Edelgaskonfiguration zu erreichen. Dadurch werden die Metalle zu positiv geladenen Ionen, also zu Metall-Kationen. Diese sind auch unter dem Begriff Atomrümpfe bekannt und besetzen feste Gitterplätze in einem Metallgitter. Die Valenzelektronen sind im Gitter als Elektronengas frei beweglich und können sich sogar von einem Ende zum anderen Ende des Metalls bewegen. Da sie dabei keine bestimmte Richtung haben, wird von einer ungerichteten Bindung gesprochen.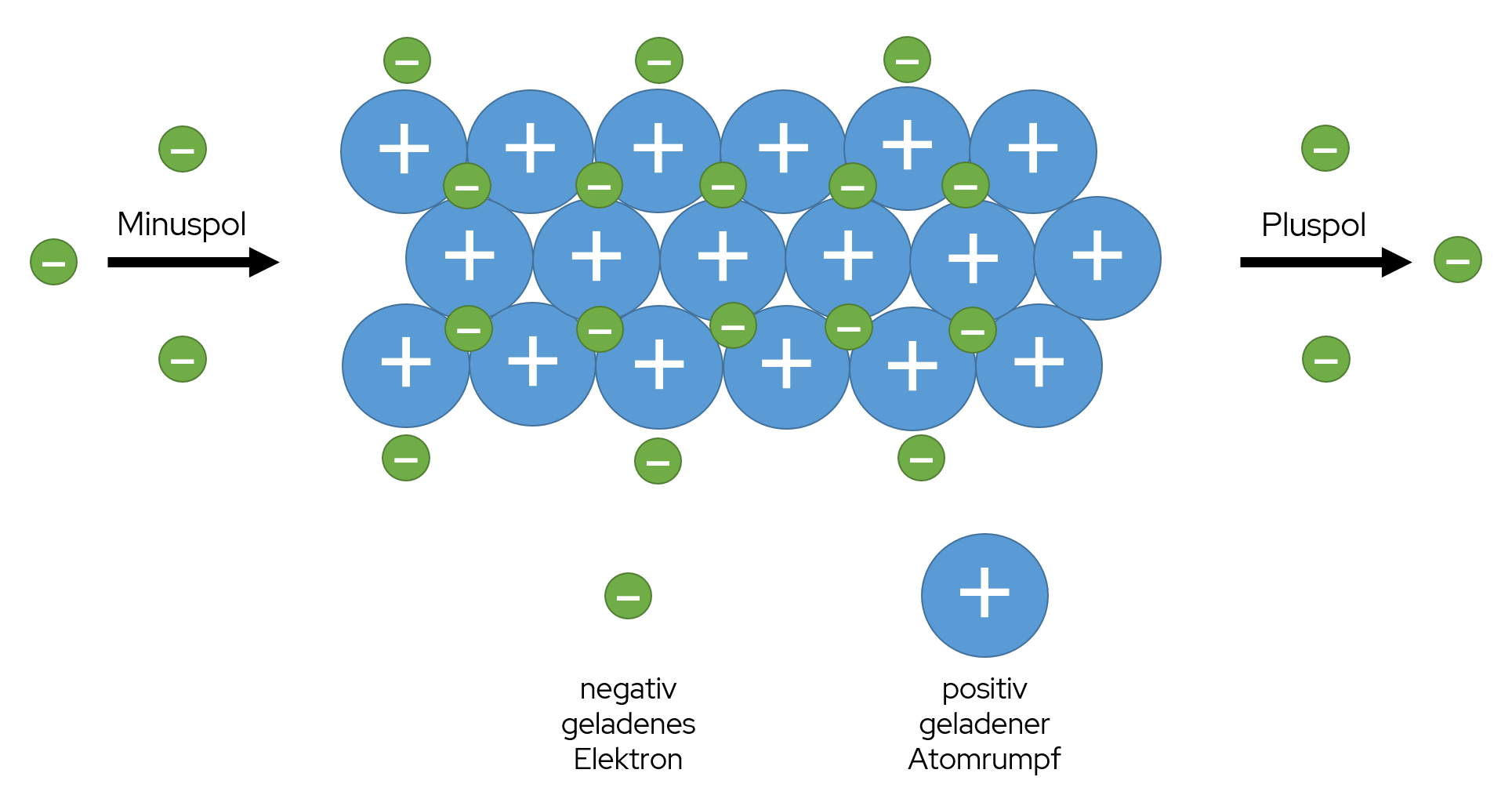
Das Elektronengasmodell von Joane Dotten Auch mit dem Bändermodell lässt sich die Metallbindung beschreiben. Dabei besitzen die Orbitale von zwei Metall-Atomen die gleiche Energie. Werden diese Atome dann zusammengefügt, spaltet sich das Energieniveau auf. Es entstehen Molekülorbitale, welche aber nicht mehr die gleiche Energie haben. Je mehr Atome dazukommen, desto kompakter liegen die Energieniveaus und die Molekülorbitale übereinander. Daher kommt auch der Name des Modells, da übereinanderliegende Energieniveaus kaum voneinander getrennt werden können und somit ein (Energie-)Band formen. Das oberste Band ist das Leitungsband und das darunter liegende Band wird auf Grund der Valenzelektronen als Valenzband bezeichnet.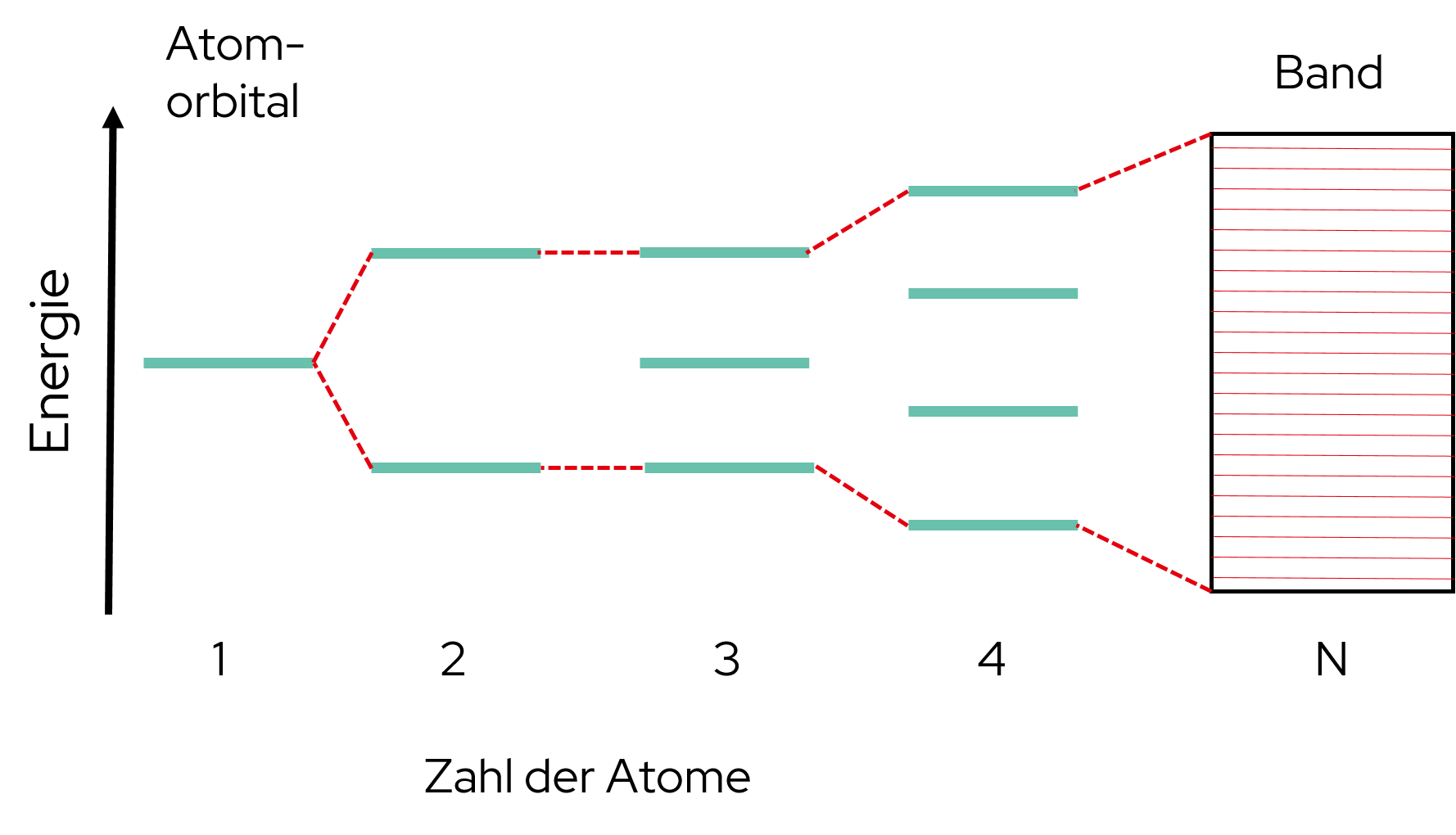
Das Bändermodell von Joane Dotten -
Wasserstoffbrückenbindung
Wasserstoffbrückenbindung... Der Name verrät schon was, oder? 😄 Tatsächlich ist bei dieser Wechselwirkung ein Wasserstoffatom beteiligt! Die Wasserstoffbrückenbindung ist die stärkste zwischenmolekulare Wechselwirkung und entsteht zwischen einem Wasserstoffatom, welches an ein Molekül gebunden ist, und einem stark elektronegativen Atom eines zweiten Moleküls. Oft ist das Atom des zweiten Moleküls Stickstoff (N), Sauerstoff (O) oder Fluor (F). Außerdem braucht das elektronegative Atom mindestens ein freies Elektronenpaar.
Zwei Situationen sorgen für die Entstehung einer Wasserstoffbrückenbindung. Einmal zwischen zwei Molekülen, so wie oben beschrieben, oder aber zwischen zwei voneinander getrennten Abschnitten eines größeren Makromoleküls. Damit diese Bindungen überhaupt zustande kommen, muss sich das Wasserstoffatom an ein Atom binden, welches eine deutlich höhere Elektronegativität hat. Das elektronegative Atom besitzt mindestens ein freies Elektronenpaar. Damit du das Ganze besser nachvollziehen kannst, möchte ich dir ein Beispiel für eine Wasserstoffbrückenbindung geben und was eignet sich dazu besser als Wasser selbst 🌊
Ein Wassermolekül (H2O) besteht aus zwei Wasserstoffatomen und einem Sauerstoffatom. Die Wasserstoffbrückenbindung bildet sich hierbei zwischen den zwei Wasserstoffatomen der zwei fremden Wassermoleküle und dem Sauerstoffatom eines Wassermoleküls. Jedes Wassermolekül kann insgesamt vier Wasserstoffbrückenbindungen eingehen, indem sich die zwei Wasserstoffatome an zwei andere Sauerstoffatome binden und das eigene Sauerstoffatom eine Bindung mit zwei anderen Wasserstoffatomen eingeht. Auf Grund der starken Elektronegativität des Sauerstoffatoms werden die negativen Elektronen des Wasserstoffatoms angezogen, so dass das Sauerstoffatom nun eine negative Teilladung aufweist. Dem Wasserstoffatom fehlen jetzt negative Elektronen, wodurch eine positive Teilladung entsteht. Die negative Teilladung des Sauerstoffatoms tritt nun in Wechselwirkung mit der positiven Teilladung des Wasserstoffatoms. Die Wasserstoffbrückenbindung ist diese erwähnte Wechselwirkung.
Wie ich schon gesagt habe, sind Wasserstoffbrückenbindungen die stärkste zwischenmolekulare Wechselwirkung. Deshalb wird auch viel Energie benötigt, um eine Wasserstoffbrückenbindung wieder zu lösen. Bei Wasser geschieht dies beispielsweise durch die Siedetemperatur von 100 °C. Diese sorgt dafür, dass Wassermoleküle von der flüssigen Phase in die Gasphase übergehen und so der feste Zusammenhalt zwischen den Molekülen aufgebrochen wird. -
Van-der-Waals-Kräfte
Die van-der-Waals-Kräfte kommen durch Anziehung zwischen Dipolen (besitzen einen positiv und einen negativ geladenen Pol) zustande. Sie sind also elektrischer Natur. Im Gegensatz zur Kovalenten Bindung oder der Ionenbindung sind van-der-Waals-Kräfte von schwächerer Natur. Die Wechselwirkungsenergie nimmt sogar mit wachsendem Abstand der Atome oder Moleküle weiter ab. Außerdem solltest du dir merken, dass es sich bei den van-der-Waals-Kräften nicht um eine Bindung handelt, sondern um eine Wechselwirkung. Wie bereits im Einführungstext erwähnt, lassen sich die van-der-Waals-Kräfte in drei Typen unterscheiden: dem Richteffekt, dem Induktionseffekt und dem Dispersionseffekt.
Nun kommen wir mal zu der Entstehung der van-der-Waals-Kräfte: Moleküle bestehen, wie wir bereits wissen, aus zwei oder mehr Atomen, die miteinander verbunden sind (Stichwort kovalente Bindung❗️). In den einzelnen Molekülen sind die Elektronen frei beweglich, dadurch sind die Ladungen innerhalb des Moleküls zeitweise ungleichmäßig verteilt. Ist dann auch noch der größe Abstand zwischen den Ladungen erreicht, wird dieses Phänomen unter dem Begriff Dipol zusammen gefasst. Die positive Ladung eines Moleküls und die negative Ladung eines Nachbarmoleküls ziehen sich gegenseitig an, genau wie bei einem Magneten. Dieser Effekt hat aber zur Folge, dass auch das Nachbarmolekül eine ungleichmäßige Ladungsverteilung aufweist und sich das Ganze so auf die weiteren Moleküle fortsetzt.
Es kann vorkommen, dass Moleküle nur sogenannte temporäre Dipole bilden. Das liegt an der sich ständig veränderten Elektronenverteilung. Darüber hinaus müssen die Moleküle für einen temporären Dipol eine recht ähnliche Elektronegativität besitzen. Es kann aber auch passieren, dass ein Dipol in ein unpolares Molekül induziert wird. Du verstehst nur Bahnhof❔ Lass es mich erklären 👩🏫. Ein einseitig negativ geladenens Teilchen kommt einem anderen Teilchen sehr nahe. Im unpolaren Teilchen werden dadurch die Elektronen verdrängt, es entsteht also eine positiv geladene Seite. Und was passiert wenn wir eine negativ und eine positiv geladene Seite haben? Richtig, sie ziehen sich an!Du solltest also folgende drei Szenarien behalten 🤓:- Zwei temporäre Dipole treffen aufeinander und ziehen sich an. Das wird auch als Richteffekt bzw. Dipol-Dipol-Kräfte bezeichnet.
- Ein
temporärer Dipol trifft auf ein ungeladenes Teilchen und induziert
dadurch einen Dipol, so dass es auch hier zur Anziehung kommt. Das ist
der Induktionseffekt.
- Oder aber ein bereits induzierter Dipol bzw. polarisiertes Molekül induziert ebenfalls einen Dipol in einem ungeladenen Teilchen. Das wäre dann der sogenannte Dispersionseffekt.
Kurz zusammen gefasst kann man zu den van-der-Waals-Kräften also sagen, dass sie auf dem Vorhandensein und der Entstehung von Dipolen beruhen. Dipole können dabei induziert werden, permanent sein oder aber auch nur temporär vorliegen. Das heißt, Dipole können sich ziemlich schnell wieder zurückbilden, jedoch auch direkt neu gebildet werden. 😋 - Zwei temporäre Dipole treffen aufeinander und ziehen sich an. Das wird auch als Richteffekt bzw. Dipol-Dipol-Kräfte bezeichnet.
-
Übersicht: Chemische Bindungen
Bei so vielen Bindungsarten kann es schonmal leicht passieren, dass man den Überblick verliert. Um dem vorzubeugen, habe ich dir hier eine kleine Übersicht zusammen gestellt. Falls du dir also nicht sicher bist, was nochmal die Bindungskräfte von der Metallbindung sind, kannst du sie ganz einfach hier nachschauen! 😉Ionenbindung Atombindung Metallbindung Zwischenmolekulare Kräfte Teilchen, zwischen denen die Bindung wirksam ist Ionen Atome Atome Moleküle Bindungskräfte Anziehungskräfte zw. entgegengesetzt geladenen Ionen Anziehungskräfte zw. gemeinsamen Elektronenpaaren und den Atomkernen Anziehungskräfte zw. positiv geladenen Metall-Ionen und dem Elektronengas Anziehungskräfte zw. permanenten oder temporären Dipolen Entstehende Strukturen Ionengitter (Ionenkristall) bei Feststoffen: Atomgitter (Atomkristall) Metallgitter (Metallkristall) bei Feststoffen: Molekülgitter (Molekülkristall) Eigenschaften kristalliner Feststoffe hohe Schmelz- und Siedetemperaturen; keine Verformbarkeit; keine elektrische Leitfähigkeit (nur in der Schmelze oder in Lösung) sehr hohe Schmelz- und Siedetemperaturen, keine Verformbarkeit; (meist) keine elektrische Leitfähigkeit niedrige bis hohe Schmelz- und Siedetemperaturen; Verformbarkeit; elektrische Leitfähigkeit niedrige Schmelz- und Siedetemperaturen; keine Verformbarkeit; keine elektrische Leitfähigkeit Beispiele kristalliner Feststoffe Natriumchlorid (Kochsalztyp); Zinksulfid DiamantGraphitKupfer
Magnesium
WolframEis
Iod
Schwefel