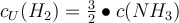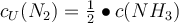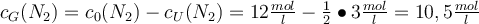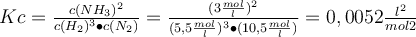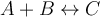Chemie 05 - Das chemische Gleichgewicht
Abschnittsübersicht
-
-
Was ist das chemische Gleichgewicht❔❓
Das chemische Gleichgewicht und das Massenwirkungsgesetz stellen die Grundlagen dar, die benötigt werden um chemische Reaktionen zu verstehen. Die meisten chemischen Reaktionen sind umkehrbar bzw. reversibel, das heißt die Reaktion kann in beiden Richtungen stattfinden. Es kann also eine Hin- oder Rückreaktion geben. Außerdem stellt sich bei diesen reversiblen Reaktionen mit der Zeit ein sogenanntes chemisches Gleichgewicht ein. Reaktionen, die in der Lage sind einen Gleichgewichtszustand innezuhaben, werden auch als Gleichgewichtsreaktionen bezeichnet. Voraussetzung dafür ist, wie oben schon erwähnt, dass die Reaktion reversibel ist und dass keines der Edukte oder Produkte aus dem Reaktionsgefäß entweichen kann (z.B. als Gas). Es muss sich also um ein geschlossenes System handeln, damit sich ein Gleichgewicht einstellen kann. Ein geschlossenes System kann beispielsweise ein Reagenzglas mit Korken sein.
In der Chemie bedeutet ein Stillstand einer Reaktion nicht, dass sie komplett abgelaufen ist oder sich die Produkte vollständig in Edukte umgewandelt haben. Es liegen hingegen viel öfter Produkte und Edukte gleichzeitig vor und wandeln sich fortlaufend ineinander um. Aber Vorsicht: verwechsle den Begriff "Gleichgewicht" nicht damit, dass sich die Hin- und Rückreaktion in Waage befinden, denn meist liegt das Gleichgewicht vermehrt auf einer Seite der Reaktion. Um herauszufinden auf welcher Seite das ist, wird das Massenwirkungsgesetz benötigt. Das lernst du auch noch im Laufe dieses Moduls kennen, genauso wie die Faktoren, die das chemische Gleichgewicht beeinflussen können.
Der nachfolgende Link führt zu einer externen Internetseite, die ggf. andere Datenschutzvorgaben erfüllt als wir es auf dieser Plattform tun. Dabei können Daten von dir übertragen und weiterverarbeitet werden. Wenn du dich allgemein zum Thema Datenschutz erkundigen möchtest, empfehlen wir dir die Erklärvideos der Initiative Datenschutz geht zur Schule.Bekannte Beispiele bei dem das chemische Gleichgewicht eine essentielle Rolle spielt ist zum Einen die Ammoniaksynthese nach dem Haber-Bosch-Verfahren und zum Anderen die Chlor-Herstellung nach dem Deacon-Verfahren. Vielleicht hast du eins von Beiden ja schonmal gehört, wenn nicht, kannst du gerne unter den Verlinkungen mehr darüber erfahren 😋
Um dir das Ganze nochmal verständlicher näher zu bringen, hier ein Beispiel: Der Professor steht an der Tafel und erklärt den Studierenden etwas. Diese sind aber so gelangweilt, dass sie anfangen mit Papierschwalben nach dem Professor zu werfen. Nach ein paar Minuten hat der Professor genug und fängt an die Papierschwalben zurück zu werfen. Zu dem Zeitpunkt liegen jeweils 9 Schwalben bei den Studierenden und 9 Schwalben beim Professor. Nach einiger Zeit stellt sich ein Gleichgewichtszustand ein, in diesem Fall haben die Studierenden noch sechs Papierflieger in ihrem Feld und der Professor zwölf Schwalben. Beide werfen weiterhin Papierflieger auf das Feld des anderen, aber der Gleichgewichtszustand verändert sich trotz alledem nicht, es hat sich ein dynamisches Gleichgewicht eingestellt. Das Ganze kann als Gleichgewichtsreaktion betrachtet werden.
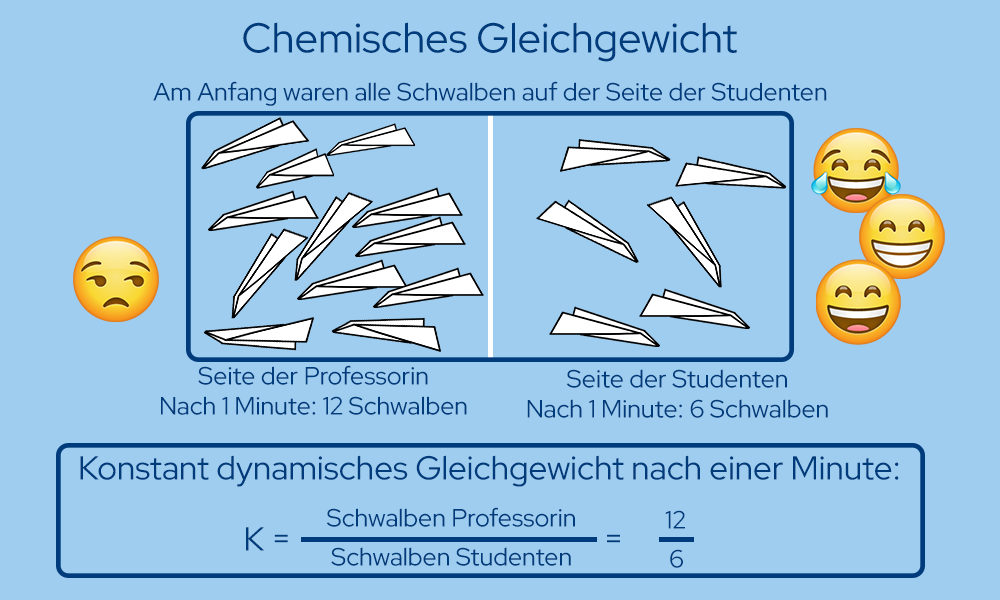
Darstellung des Chemischen Gleichgewichts von Nick Donner -
Reaktionsgleichungen ausgleichen ☯️
Für die nächsten Lerneinheiten ist es sinnvoll, dass du Reaktionsgleichungen verstehst und sogar selbst ausgleichen kannst. Aus diesem Grund gibt es hier nun eine Lerneinheit dazu 👀Das Aufstellen von Reaktionsgleichungen macht dir ein wenig Angst, weil die im Chemiebuch, an der Tafel oder wo auch immer super kompliziert aussehen? Keine Panik, es ist leichter als du denkst und mit ein paar Regeln bzw. Schritten als Hilfe, für dich kein Problem mehr! 😎Zunächst ist es wichtig zu wissen, dass die Edukte immer auf der linken Seite und die Produkte immer auf der rechten Seite der Reaktionsgleichung stehen. Das Einzige was sie trennt ist der Reaktionspfeil → bzw. der Doppelpfeil ⇌. Bsp.:
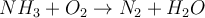 Der Doppelpfeil ⇌ wird für Gleichgewichtsreaktionen verwendet, was bedeutet, dass die Hinreaktion von links nach rechts läuft. Der Reaktionspfeil → wird dann benutzt, wenn beide Seiten nicht vertauscht werden dürfen. Es gibt noch weitere Reaktionspfeile, die für uns aber erstmal nicht relevant sind. Wenn du trotzdem neugierig bist kannst du hier etwas dazu nachlesen: ReaktionspfeileDer nachfolgende Link führt zu einer externen Internetseite, die ggf. andere Datenschutzvorgaben erfüllt als wir es auf dieser Plattform tun. Dabei können Daten von dir übertragen und weiterverarbeitet werden. Wenn du dich allgemein zum Thema Datenschutz erkundigen möchtest, empfehlen wir dir die Erklärvideos der Initiative Datenschutz geht zur Schule.
Der Doppelpfeil ⇌ wird für Gleichgewichtsreaktionen verwendet, was bedeutet, dass die Hinreaktion von links nach rechts läuft. Der Reaktionspfeil → wird dann benutzt, wenn beide Seiten nicht vertauscht werden dürfen. Es gibt noch weitere Reaktionspfeile, die für uns aber erstmal nicht relevant sind. Wenn du trotzdem neugierig bist kannst du hier etwas dazu nachlesen: ReaktionspfeileDer nachfolgende Link führt zu einer externen Internetseite, die ggf. andere Datenschutzvorgaben erfüllt als wir es auf dieser Plattform tun. Dabei können Daten von dir übertragen und weiterverarbeitet werden. Wenn du dich allgemein zum Thema Datenschutz erkundigen möchtest, empfehlen wir dir die Erklärvideos der Initiative Datenschutz geht zur Schule.Alles weitere was du zum Aufstellen von Reaktionsgleichungen brauchst, lernst du im 👉 LearningSnack 👈. Also auf geht's! 🥳
Alternativ zum Learning Snack kannst du dir auch das nachfolgende Video zum Ausgleichen von Reaktionsgleichungen ansehen 🎬 Und bitte hab einen Moment Geduld falls das Video nicht unmittelbar lädt 😉
Hier geht es erst weiter, wenn du den LearningSnack absolviert hast! 🚧🚧🚧Der nachfolgende Link führt zu einer externen Internetseite, die ggf. andere Datenschutzvorgaben erfüllt als wir es auf dieser Plattform tun. Dabei können Daten von dir übertragen und weiterverarbeitet werden. Wenn du dich allgemein zum Thema Datenschutz erkundigen möchtest, empfehlen wir dir die Erklärvideos der Initiative Datenschutz geht zur Schule.So nachdem du die Sperre durch das erfolgreiche Abschließen des LearningSnacks aufgehoben hast, kannst du entweder mit Hilfe der nachfolgenden 👉 Simulation 👈 von PhET dein Wissen mit Spaß festigen oder du machst direkt Ernst und gehst zu den Übungen 🤪
Zu den Übungen geht es hier entlang ⬇⬇⬇ 🏃♂️🏃♀️ -
Massenwirkungsgesetz ⚖️
Der nachfolgende Link führt zu einer externen Internetseite, die ggf. andere Datenschutzvorgaben erfüllt als wir es auf dieser Plattform tun. Dabei können Daten von dir übertragen und weiterverarbeitet werden. Wenn du dich allgemein zum Thema Datenschutz erkundigen möchtest, empfehlen wir dir die Erklärvideos der Initiative Datenschutz geht zur Schule.Um vorab das Massenwirkungsgesetz kennenzulernen und einen Eindruck davon zu bekommen, habe ich dir ein Video von Duden Learnattack verlinkt. Ab geht's!
Jetzt wo du bereits die Grundlagen des Massenwirkungsgesetzes kennst, wollen wir mal ein wenig tiefer in die Materie eintauchen. Vor dir steht ein Becherglas mit einem Volumen von 1 Liter. Dort gibst du jetzt 10 mol H2 (Wasserstoff) und 12 mol N2 (Stickstoff) zur Reaktion in das Becherglas. Dabei entsteht NH3 (Ammoniak) mit einer Konzentration von 3 mol/L. Du sollst jetzt die dazugehörige Gleichgewichtskonstante Kc berechnen. Wie gehst du also vor? 🤔
Schau dir dazu nun die Schritt für Schritt "Anleitung" an oder springe direkt zum Video 📽 weiter unten.Zunächst solltest du die Reaktionsgleichung aufstellen und ausgleichen. Da du das ja bereits weiter oben in diesem Modul gelernt hast, ist das für dich ja ein Klacks. Zur Kontrolle ist hier das Ergebnis auf das ich gekommen bin:
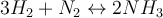
Mit Hilfe der Reaktionsgleichung kannst du jetzt das Massenwirkungsgesetz aufstellen:
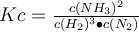 . Um dieses aber anwenden zu können, brauchst du die Reaktionen aller Reaktanden im Gleichgewicht. Dafür musst
du zunächst die anfänglichen Konzentrationen der Edukte bestimmen. Das geht indem du die Stoffmenge durch das Volumen teilst:
. Um dieses aber anwenden zu können, brauchst du die Reaktionen aller Reaktanden im Gleichgewicht. Dafür musst
du zunächst die anfänglichen Konzentrationen der Edukte bestimmen. Das geht indem du die Stoffmenge durch das Volumen teilst: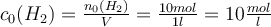
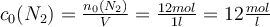
Gar nicht so schwer oder? Nachfolgend benötigst du noch die Konzentrationsänderungen des Wasserstoffs (H2) und des Stickstoffs (N2) durch die Reaktion zum Ammoniak (NH3) bis der Gleichgewichtszustand erreicht wurde. Klingt ziemlich kompliziert, ist es aber gar nicht:
Mit Hilfe der stöchiometrischen Koeffizienten in der Reaktionsgleichung ermittelst du die Stoffmengenverhältnisse der Edukte zu den Produkten. Da das Volumen in unserem Becherglas konstant bleibt, kannst du die Verhältnisse durch Kürzen direkt auf die Konzentrationen übertragen:
Jetzt hast du alles Nötige zusammen, um du die Konzentrationen von Wasserstoff und Stickstoff im Gleichgewicht zu berechnen:
Diese Werte musst du jetzt nur noch in das Massenwirkungsgesetz einsetzen und voilà schon hast du die Gleichgewichtskonstante Kc berechnet! 💃 🕺
Die Gleichgewichtskonstante ist in diesem Fall Kc < 1, es gibt also mehr Edukte als Produkte und das Gleichgewicht liegt auf der linken Seite.
Ist Kc > 1, liegen hingegen mehr Produkte als Edukte vor und das Gleichgewicht liegt auf der rechten Seite.
Du solltest beachten, dass die Einheit für Kc NICHT immer die Gleiche ist! Kc hängt nämlich von den berechneten Parametern ab wie z.B. Konzentration oder Stöchiometrie.Im Folgenden kannst du dir die Berechnung von Kc auch noch mal als Video ansehen 🎬 Bitte hab etwas Geduld falls das Video nicht sofort lädt 😉Puh, das war ganz schön viel oder? 🤯 Aber keine Sorge, mehr Input bekommst du in dieser Lerneinheit nicht. Du kannst jetzt zu dem spaßigen Teil übergehen: der Anwendung deines neu erworbenen Wissens!!! 🤩🎉⬇️ Ab zu den tollen Übungsaufgaben ⬇️ -
Berechnung der Gleichgewichtskonstanten Kc
Damit du nicht immer den ganzen Text absuchen musst, wenn du eine Gleichgewichtskonstante berechnen willst, habe ich dir hier eine kleine Zusammenfassung der relevanten Schritte zusammen gestellt 😉Schritt 1: Berechne die anfänglichen Konzentrationen c0 der Edukte. Dazu musst du die Stoffmenge durch das Volumen teilen.
Bsp.: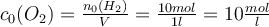
Schritt 2: Bestimme die Konzentrationsänderungen n der Edukte durch die Reaktion der Produkte. Dazu teilst du die Konzentration Edukte durch die der Produkte.
Bsp.: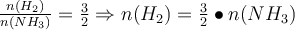
Schritt 3: Bestimme die Stoffmengenverhältnisse cUmsatz der Edukte zu den Produkten.
Bsp.: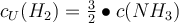
Schritt 4: Berechne alle Konzentrationen der Edukte im Gleichgewicht.
Bsp.: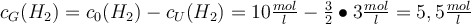
Schritt 5: Setze die Werte in das Massenwirkungsgesetz ein und voilà schon hast du die Gleichgewichtskonstante Kc berechnet!
Bsp.: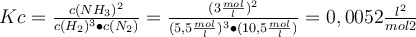
-
Einfluss eines Katalysators
Als Katalysator wird ein Stoff bezeichnet, der dafür sorgt, dass eine chemische Reaktion beschleunigt oder aber verlangsamt wird 🏃♀️🚶♀️. Die Hin- und Rückreaktion läuft also entweder schneller oder langsamer ab. Toll an der ganzen Sache ist, die Reaktion wird beschleunigt und der Katalysator selbst wird dabei nicht verbraucht. Abgefahren, oder? 🤯
Damit manche Reaktionen überhaupt ablaufen können, wird ein Katalysator benötigt. Bei einer chemischen Reaktion müssen die Reaktionsparameter eine energetische Barriere überwinden, die Aktivierungsenergie. Um das Ganze etwas besser zu veranschaulichen, kannst du dir die Aktivierungsenergie wie einen Berg vorstellen, den die Reaktionsparameter erklimmen müssen 🧗♀️🧗♂️. Oft schaffen diese es aber nicht allein nach oben und brauchen Hilfe. Da kommt der Katalysator ins Spiel. Durch die Herabsetzung der Aktivierungsenergie, beschleunigt der Katalysator die chemische Reaktion. Der Katalysator sorgt also dafür, das unser Berg kleiner wird und somit für die Reaktionsparameter bezwingbar ist. Damit das passieren kann, muss der Katalysator selbst an der Reaktion teilnehmen und sich an einen der Reaktionsparameter binden. Dies wird als Übergangszustand bezeichnet. Im nachfolgenden Diagramm siehst du auch nochmal den kleiner gewordenen Berg und die verringerte Aktivierungsenergie.
Grafische Darstellung des Katalysatoreinflusses von Joane Dotten Jetzt hast du einige Merkmale des positiven Katalysators kennen gelernt. Ahnst du schon was als nächstes kommt? Richtig! Der negative Katalysator. Im Gegensatz zum positiven Katalysator verlangsamt der negative Katalysator die Reaktion in dem er die Aktivierungsenergie erhöht. Eine Gemeinsamkeit der positiven und negativen Katalysatoren ist, dass sie selektiv sind. Sie beschleunigen folglich nur bestimmte Reaktionen.- Merke dir also:
- Mit Hilfe eines Katalysators erreichen Ausgangsstoffe schneller den Übergangszustand.
- Die Ausgangsstoffe werden in einer katalytischen Reaktion in eine oder mehrere Produkte umgewandelt.
- Der Katalysator wurde während der Reaktion nicht verbraucht und ist somit wieder verwendbar.
Es gibt aber noch ein weiteres Entscheidungsmerkmal bei Katalysatoren, den Aggregatzustand. Der homogene Katalysator besitzt denselben Aggregatzustand wie die Reaktionsparameter. Alle Reaktionsteilnehmer sind dann entweder fest, flüssig oder gasförmig. Beim heterogenen Katalysator hat der Katalysator einen anderen Aggregatzustand als die restlichen Reaktionsteilnehmer. Liegt der Katalysator beispielsweise in flüssiger Form vor, können die anderen Reaktionsteilnehmer entweder fest oder gasförmig sein. Gar nicht so schwer oder? 😉 - Merke dir also:
-
Das Prinzip von Le Chatelier
Um das Nachfolgende besser zu verstehen, solltest du wissen, was eine endotherme Reaktion und was eine exotherme Reaktion ist. Das ist eigentlich recht simpel. Unter einer endothermen Reaktion versteht man die Aufnahme von Energie aus der Umgebung. Bei einer exothermen Reaktion passiert genau das Gegenteil. Energie wird an die Umgebung abgegeben. 💡💡💡Vor ganz schön langer Zeit, nämlich 1884, haben die Chemiker Henry Louis Le Châtelier und Ferdinand Braun ein Prinzip formuliert, welches die Änderung von Gleichgewichtslagen vorhersagen kann. Vielleicht hast du ja auch schonmal davon gehört, es ist das Prinzip des kleinsten Zwanges.
Dieses Prinzip sagt aus: Wird ein äußerer Zwang auf ein im Gleichgewicht befindliches System ausgeführt, dann weicht das System diesem Zwang aus, indem es eine neue Gleichgewichtslage einstellt. Das heißt, es entstehen laufend immer gleich viele Edukte wie Produkte, deren Konzentration sich dabei nicht verändert. Der äußere Zwang kann sowohl eine Änderung der Temperatur T sein, als auch eine Änderung des Drucks p oder der Stoffmengenkonzentration c.
Tatsächlich lässt sich bei Bedarf auch die Geschwindigkeit, in der der Gleichgewichtszustand erreicht wird, beeinflussen. Denn wenn die Temperatur erhöht oder ein Katalysator verwendet wird, stellt sich der Gleichgewichtszustand schneller ein. Alles rund um den Katalysator findest du in der vorigen Lerneinheit "Einfluss eines Katalysators".
Die möglichen Änderungen der Temperatur, des Drucks und der Konzentration und wie diese die Gleichgewichtslage beeinflussen, schauen wir uns jetzt nochmal im Detail an 🧐 -
Änderung der Temperatur 🌞⛄
Die Lage des Gleichgewichts ist meist abhängig von der Temperatur, da die Temperatur und der Gleichgewichtszustand sich gegenseitig bedingen. Um überhaupt eine Aussage über die Gleichgewichtslage bei Temperaturänderung treffen zu können, musst du aber zunächst wissen, ob die Reaktion endotherm oder exotherm verläuft.
Wie du im letzten Abschnitt bereits gelernt hast, bedeutet exotherm die Abgabe von Wärme. Eine Reaktion unterliegt also nur dann dem geringsten Zwang, wenn Wärme abgeführt wird. Daraus ergibt sich, dass das Gleichgewicht bei einer Temperaturverringerung immer zur exothermen Teilreaktion tendiert. Ist die Reaktion hingegen endotherm, wird Energie aus der Umgebung aufgenommen und so dem System Wärme entzogen. Es muss also Wärme zugeführt werden, damit die Reaktion dem kleinsten Zwang unterliegt. Durch eine Temperaturerhöhung wird also das Gleichgewicht bei der endothermen Teilreaktion liegen.
Ob eine Reaktion endotherm oder exotherm ist, erkennst du an der Differenz der Enthalpie ΔH. Vielleicht hast du das Zeichen schonmal hinter einer Reaktionsgleichung gesehen: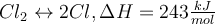 . ΔH kann negativ, also kleiner 0, oder aber positiv, größer 0, sein. Und genau das ist der entscheidende Hinweis den du brauchst, um zu wissen ob die Reaktion endotherm oder exotherm ist. Ist ΔH < 0 bzw. negativ handelt es sich um eine endotherme Reaktion, ist ΔH > 0 bzw. positiv, dann ist es eine exotherme Reaktion.
. ΔH kann negativ, also kleiner 0, oder aber positiv, größer 0, sein. Und genau das ist der entscheidende Hinweis den du brauchst, um zu wissen ob die Reaktion endotherm oder exotherm ist. Ist ΔH < 0 bzw. negativ handelt es sich um eine endotherme Reaktion, ist ΔH > 0 bzw. positiv, dann ist es eine exotherme Reaktion. So und jetzt nochmal ein Beispiel zu der ganzen Sache, dann ist es für dich ein wenig greifbarer 😊 Dafür schauen wir uns das Gasgemisch zwischen Stickstoffdioxid und Distickstofftetroxid an:
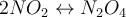
Wir wollen zunächst wissen, ob es sich um eine endotherme oder exotherme Reaktion handelt. Die Enthalpie der Reaktion ist ΔH = -58 kJ/mol. Also ist es eine endotherme Reaktion und Energie wird aus der Umgebung aufgenommen. Wird nun die Temperatur bei konstantem Volumen erhöht, so läuft die Reaktion in die endotherme Richtung, also verschiebt sich das Gleichgewicht nach links. Das kann man dem Gasgemisch auch ansehen, es wird dunkler. Was passiert also wenn wir die Temperatur senken? Na klar, es spielt sich eine exotherme Reaktion ab und das Gleichgewicht verschiebt sich nach rechts. Auch das kann man dem Gasgemisch wieder ansehen, denn es hellt sich auf. Wahnsinn, oder? 🤯🤯🤯
Merksätze 🧐:- Bei einer Temperaturerhöhung läuft die endotherme Reaktion verstärkt ab.
- Bei einer Temperaturerniedrigung läuft die exotherme Reaktion verstärkt ab.
-
Änderung des Drucks 🍾
Wird der Druck verändert, so ändert sich auch das Gleichgewicht, vorausgesetzt Gase sind beteiligt. Außerdem muss sich das Volumen der Ausgangsstoffe vom Volumen der Reaktionsprodukte unterscheiden. Merke dir auch, dass das Gleichgewicht bei einer Druckänderung nur dann beeinflusst wird, wenn das Ganze in einem geschlossenen System statt findet. Diese Gleichgewichtsänderungen schauen wir uns jetzt etwas genauer an im Hinblick auf die Veränderungen bei Druckanstieg oder Druckverminderung. 👀
Bei einem Druckanstieg steigt die Konzentration aller Teilchen an, während das Volumen abnimmt. Es steht also weniger Volumen zur Verfügung, was zur Folge hat, dass die Bildung von kleinen wenigen Teilchen sich dem kleineren Zwang beugen muss. Bei einer Druckverminderung ist das Ganze genau andersherum. Das Volumen nimmt bei einer Druckminderung also zu, so dass die Bildung von großen vielen Teilchen dem kleineren Zwang unterworfen ist. 💡
Als Beispiel für die Beeinflussung durch Druck auf das Gleichgewicht möchte ich dir das Haber-Bosch-Verfahren präsentieren.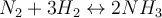
Aus 4 Gasmolekülen auf der Eduktseite (links) entstehen 2 Gasmoleküle auf der Produktseite (rechts). Wenn wir jetzt den Druck erhöhen würden, würde das System versuchen diesem auszuweichen. Das Gleichgewicht würde auf die volumenmindernde Seite ausweichen und die Anzahl der Gasteilchen würde verringert werden. Durch Druckerhöhung lässt sich die Bildung von Ammoniak also unterstützen.
Aber tatsächlich ist Druck nicht das Einzige was das Gleichgewicht beeinflusst 😯. Die Reaktion ist exotherm und benötigt eine hohe Aktivierungsenergie. Durch eine Temperaturerhöhung würde das Gleichgewicht auf die Eduktseite mit erhöhtem Volumen verschoben werden.
Merksätze 🧐:- Bei einem Druckanstieg wird die Zahl der Gasteilchen erniedrigt und das Volumen nimmt ab.
- Bei einer Druckverminderung wird die Zahl der Gasteilchen erhöht und das Volumen nimmt zu.
-
Änderung der Konzentration 👨💻
Auch hier gilt wieder: Das System versucht dem Zwang auszuweichen! 🤓
Durch die Änderung der Edukte oder Produkte, lässt sich die Ausbeute der chemischen Reaktion beeinflussen. Merke dir aber, dass sich die Lage des Gleichgewichts nicht ändert, denn die Gleichgewichtskonstante Kc bleibt unverändert.
Nehmen wir also einen Reaktionsparameter dazu bzw. weg, stört dies das Gleichgewicht. Die Reaktion läuft deshalb vermehrt in eine Richtung bis das Gleichgewicht wieder hergestellt wird. Wird also die Konzentration von einem Stoff der am Gleichgewicht beteiligt ist, verändert, so verändern sich auch die Konzentrationen aller anderen beteiligten Stoffe. Soll die Gleichgewichtsreaktion gänzlich zugunsten eines Produkts ablaufen, dann ist es ausreichend ein Edukt zu erhöhen oder aber gänzlich zu entfernen. Die Rückreaktion findet erst wieder statt, wenn das Gleichgewicht wieder hergestellt ist.
Es finden demnach zwei Fälle statt: Entweder die Konzentrationserhöhung oder die Konzentrationserniedrigung. Wenn wir von einer Konzentrationserhöhung bei einer allgemeinen Reaktion ausgehen
führt eine Erhöhung der Stoffmengenkonzentration von A oder B zu einer Gleichgewichtsverschiebung nach rechts. Das System versucht diesem Zwang durch den Abbau von Edukten auszuweichen. Wird hingegen die Stoffmengenkonzentration von C erhöht, dann verschiebt sich das Gleichgewicht nach links.
Gehen wir jetzt aber von einer Konzentrationserniedrigung bei einer allgemeinen Reaktion aus
führt eine Erniedrigung der Stoffmengenkonzentration von A oder B zu einer Gleichgewichtsverschiebung nach links. Das System versucht diesem Zwang durch die Bildung von Edukten auszuweichen. Wird hingegen die Stoffmengenkonzentration von C erniedrigt, dann verschiebt sich das Gleichgewicht nach rechts.
- Merksätze 🧐:
- Wird die Konzentration von Edukten erhöht, dann werden verstärkt Produkte gebildet und umgekehrt.
- Wird die Konzentration eines Produkts erniedrigt, dann läuft verstärkt eine Hinreaktion ab.
- Merksätze 🧐: