Organische und anorganische Kohlenstoffverbindungen
Abschnittsübersicht
-
Bearbeitungsdauer ⏱ : ca. 90-120 minDas folgende Modul soll dir alles rund um Kohlenstoffverbindungen näher bringen. Dabei gehen wir unter anderem in die Darstellungsformen organischer Verbindungen und die systematische Einteilung der Kohlenwasserstoffe ein. Du wirst außerdem lernen organische Verbindungen zu benennen und sogar selbst zu zeichnen. Viel Spaß! 😊
Nach der Bearbeitung des Moduls solltest du:
- wissen, weshalb der Kohlenstoff eine Sonderstellung in der Familie der chemischen Elemente einnimmt
- verschiedene Darstellungsformen organischer Verbindungen beherrschen
- die Lewis-Schreibweise sowie die Strich- und Skelettformel-Schreibweise draufhaben
- die systematische Einteilung der Kohlenwasserstoffe nachvollziehen können
- wissen, was eine funktionelle Gruppe ist und ihren Aufbau kennen
- einfache organische Verbindungen benennen und zeichnen können
-
Kohlenstoffverbindungen
Neben Kohlenstoff (C) ist auch Wasserstoff (H) ein wichtiger Bestandteil von organischen Verbindungen. Das sind die C-H-Bindungen, vielleicht kennst du diese bereits. Aber neben diesen beiden Elementen können auch noch Sauerstoff (O), Stickstoff (N), Schwefel (S), Phosphor (P) und die Halogene Fluor (F), Chlor (Cl), Brom (Br) und Iod (I) Bestandteil einer organischen Verbindung sein. Es gibt aber auch anorganische Verbindungen. Diese zeichnen sich dadurch aus, dass sie keine CH-Bindungen einschließen, sondern Kohlenstoff eine Verbindung mit den Chalkogenen eingeht. Als Beispiel für eine anorganische Verbindung ist deshalb Kohlenstoffdioxid (CO2). Tatsächlich sind insgesamt viel mehr organische Verbindungen bekannt, etwa 5 Millionen, als anorganische Verbindungen, nur etwa 100.000. Warum das so ist? 🤔 Dafür sind die besonderen Eigenschaften des Kohlenstoffs verantwortlich.
- Merke dir folgendes in Bezug auf organische und anorganische Verbindungen:
- organische Verbindungen erkennst du an den verknüpften Kohlenstoffatomen, die meist Wasserstoffatome gebunden haben
- anorganische Verbindungen erkennst du daran, dass keine Kohlenstoff-Wasserstoff-Bindungen vorhanden sind, sondern Kohlenstoff eine Verbindung mit Chalkogenen eingeht
Eine Besonderheit des Kohlenstoffs ist nämlich, dass er quasi als einziges Element unbegrenzt Verbindungen mit sich selbst eingehen kann 😲. Diese Verbindungen können unter anderm Ketten, Ringe, Netze und Brücken sein. Denn jedes Atom eines Moleküls möchte die Edelgaskonfiguration erreichen. Wenn du bereits das Modul zum Atomaufbau absolviert hast, weißt du was gemeint ist. Wenn nicht, die Edelgaskonfiguration bedeutet nichts anderes als das ein stabiler Zustand mit acht Außenelektronen erreicht werden möchte. Kohlenstoff besitzt vier Valenzelektronen, so dass vier Elektronenpaarbindungen mit weiteren Partnern gebildet werden können. Die Partner können hierbei unterschiedliche Elemente sein, so dass viele unterschiedliche Bindungsmöglichkeiten entstehen. Kohlenstoff kann darüber hinaus auch Doppel- und Dreifachbindungen eingehen, so dass Unmengen an Möglichkeiten zur organischen Verbindung gibt.
Eine häufige Verbindung die Kohlenstoff eingeht ist mit Wasserstoff. Das liegt daran, dass eine gewisse Ähnlichkeit zwischen Kohlenstoff- und Kohlenwasserstoffverbindungen besteht. Denn die Elektronenwolken von Kohlenstoffverbindungen und Kohlenwasserstoffverbindungen sind ähnlich kompakt, so dass die Ladungsverteilung sehr symmetrisch ist und die Elektronegativitätsdifferenz somit klein. Aufgrund der Kompaktheit der Kohlenstoff- und Kohlenwasserstoffverbindungen wird eine sehr große Aktivierungsenergie benötigt. All diese Eigenschaften machen die organischen Kohlenstoffverbindungen aus 😎.
- Merke dir folgendes in Bezug auf organische und anorganische Verbindungen:
-
Darstellung der Verbindungen
Um die Struktur von Atomen und Molekülen darzustellen gibt es verschiedene Möglichkeiten. Sobald du die Darstellung eines Moleküls siehst, solltest du in der Lage sein alle darin enthaltenen Informationen enträtseln zu können. Ansonsten wird es dir ziemlich schwer fallen selbst einfache Reaktionen zu verstehen. Deshalb werden wir uns in diesem Abschnitt mit der Lewis-Schreibweise sowie der Strich- und Skelett-Schreibweise beschäftigen. Diese werden am häufigsten verwendet und helfen dir einige Erkenntnise über die eingegangenen Verbindungen zu gewinnen 🤓.
Lewis-Schreibweise
Die Lewis-Schreibweise basiert auf der Oktettregel und den verschiedenen chemischen Bindungsarten. Hierbei sind vorallem die Valenzelektronen von großer Bedeutung. Denn es werden das Elementsymbol und die dazugehörigen Valenzelektronen durch die Lewis-Formel dargestellt. Das schauen wir uns am Beispiel von Chlor mal genauer an 🕵🏽. Die Anzahl der Valenzelektronen kannst du im Periodensystem anhand der Hauptgruppe ablesen. Chlor besitzt demnach sieben Valenzelektronen, welche mittels eines Punktes dargestellt werden. Dies sieht nach der Lewis-Schreibweise wie folgt aus:
Chlor in der Lewis-Schreibweise von Joane Dotten
Auch wenn die Lewis-Schreibweise zunächst einfach scheint, gibt es einige Dinge zu beachten ☝🏽 Da Wasserstoff und die Halogene nur ein weiteres Elektron benötigen, um die Edelgaskonfiguration zu erreichen, werden sie als einbindig bezeichnet. Die sogennante Bindigkeit eines Atoms wird durch die Anzahl der Valenzelektronen bestimmt. Sauerstoff ist demnach zweibindig, da ihm zwei Elektronen fehlen um die Oktettregel zu erfüllen. Daher muss Sauerstoff zwei Bindungen zur Erfüllung der Edelgaskonfiguration eingehen. Beispiel für ein dreibindiges Element ist Stickstoff, da er nur fünf Valenzelektronen besitzt, aber nach acht Außenelektronen strebt. Vierbindig ist, wie bereits im vorigen Abschnitt erwähnt, der Kohlenstoff. Er besitzt nur vier Valenzelektronen, muss also vier Bindungen eingehen, um die Oktettregel zu erfüllen. Langsam hast du das Sytem durchschaut oder? 😄Aber was ist jetzt mit den Edelgasen? Die haben doch bereits acht Valenzelektronen 🤔 Tatsächlich gehen diese keine weiteren Bindungen mehr ein. Ein Molekül kann aber auch mehrere Lewis-Schreibweisen haben, dann musst du die energetisch günstigere Schreibweise wählen. Energetisch günstiger meint Moleküle mit mehreren Bindungen oder aber Bindungen zwischen verschiedenen Atompartnern. Schauen wir uns das mal am Beispiel von Kohlenstoffdioxid (CO2) an:Die beiden Sauerstoffatome sind jeweils zweibindig, während der Kohlenstoff vierbindig ist. Jetzt ist zu beachten, dass das Atom mit der höchsten chemischen Wertigkeit in die Mitte geschrieben wird. Also der Kohlenstoff. Die anderen beiden Atome versuchst du nun mit dem Kohlenstoff zu verknüpfen. Beachte dabei, dass alle Moleküle die Oktettregel erfüllen müssen und es auch mehrere Verbindungsmöglichkeiten geben kann.Kohlenstoffdioxid in der Lewis-Schreibweise von Joane Dotten Der nachfolgende Link führt zu einer externen Internetseite, die ggf. andere Datenschutzvorgaben erfüllt als wir es auf dieser Plattform tun. Dabei können Daten von dir übertragen und weiterverarbeitet werden. Wenn du dich allgemein zum Thema Datenschutz erkundigen möchtest, empfehlen wir dir die Erklärvideos der Initiative Datenschutz geht zur Schule.Schauen wir uns jetzt Wasser (H2O) in der Lewis-Schreibweise an, sieht das alles ein wenig anders aus. Die beiden Wasserstoffatome haben jeweils nur ein Valenzelektron, während das Sauerstoffatom sechs Außenelektronen besitzt. Wie ordnen wir diese Atome jetzt sinnvoll an? 🤔 Da alle die Edelgaskonfiguration erreichen wollen, macht es Sinn das Sauerstoffatom zu zentrieren und die Wasserstoffatome dann damit zu verknüpfen. Es bilden sich links und rechts vom Sauerstoffatom Winkel, das liegt am Induktiven Effekt. Auf diesen möchte ich nicht weiter eingehen, aber du kannst hier gerne nachlesen, falls es dich interessiert. Das Sauerstoffatom besitzt eine höhere Elektronegativität als die beiden Wasserstoffatome, so dass die Elektronen vermehrt zum Sauerstoffatom gezogen werden.Wasser in der Lewis-Schreibweise von Joane Dotten Sehen wir uns einen weiteren Sonderfall an: Stickstoffmonoxid (NO). Das Stickstoffatom besitzt fünf Valenzelektronen und benötigt noch drei um die Edelgaskonfiguration zu erreichen. Es ist also dreibindig. Das Sauerstoffatom hingegen hat bereits sechs Valenzelektronen, benötigt somit nur noch zwei Außenelektronen für die Oktettregel. Das Sauerstoffatom ist demnach zweibindig. Das passt ja gar nicht zusammen?! 🤯 Tatsächlich würde ein freies Elektron überbleiben, weshalb diese Verbindung als Radikal bezeichnet wird. Diese Besonderheit spiegelt sich auch in der Lewis-Schreibweise wieder. Denn es gibt zwei Möglichkeiten zur Darstellung von Stickstoffmonoxid. Dies wird auch Mesomerie genannt, weshalb die beiden möglichen Verbindungen in eckigen Klammern geschrieben werden. Wie diese Molekülverbindung dann in Wirklichkeit aussieht, liegt irgendwo zwischen diesen beiden Möglichkeiten.
Stickstoffmonoxid in der Lewis-Schreibweise von Joane DottenSo jetzt solltest du in der Lewis-Schreibweise fit sein. Dann machen wir doch direkt weiter mit der Valenzstrichformel. Keine Sorge, die unterscheidet sich nicht allzu sehr von dem was du gerade gelernt hast! ☺️Valenzstrichformel
Auch die Valenzstrichformel macht sich die Valenzelektronen zu Nutze. Die Valenzelektronen werden aber nicht einzeln dargestellt, sondern jedes Elektronenpaar wird mittels eines Strichs ➖ zusammen gefasst. Dieser Strich wird als Valenzstrich bezeichnet. Auch die Verbindung zwischen den Atomen wird mittels eines Strichs dargestellt. Dabei steht ein Strich für eine Einfachbindung, zwei Striche für eine Doppelbindung usw. Das sieht am Beispiel für Kohlenstoffdioxid (CO2) wie folgt aus:
Kohlenstoffdioxid in der Valenzstrichformel von Joane Dotten
Du kannst es dir also so merken, dass die Elektronen der Lewis-Schreibweise in der Valenzstrichformel einfach nur verbunden werden. Gar nicht so schwer, oder? 😉Schauen wir uns nochmal Wasser (H2O) an:
Wasser in der Valenzstrichformel von Joane Dotten
Auch hier bestätigt sich, dass nur die Elektronen zu Strichen verbunden werden. Denn durch den induktiven Effekt werden auch in der Valenzstrichformel links und rechts vom Sauerstoffatom Winkel gebildet. Für Stickstoffmonoxid (NO) gilt selbstverständlich dasselbe. Das einzig Besondere ist das eine freie Elektron, was nicht als Strich dargestellt werden kann, sondern wie in der Lewis-Schreibweise als Punkt 🔵 abgebildet wird.
Stickstoffmonoxid in der Valenzstrichformel von Joane Dotten
Du solltest dir aber merken, dass die Atome in Wirklichkeit nicht exakt in einer Linie liegen wie in der Valenzstrichformel dargestellt. Meist ist der Bindungswinkel nämlich deutlich höher als die verwendeten 90°. Und tatsächlich gibt es auch hier wieder einen Sonderfall. Den Sauerstoff (O2)! 🤔 Sauerstoff wird mit einer Doppelbindung visualisiert, obwohl sich eine Bindung aus zwei ungepaarten Elektronen zusammensetzt. Dieser Sonderfall wird auch als Diradikal bezeichnet. Die vereinfachte Darstellung von Sauerstoff sieht wie folgt aus:
Sauerstoff in der Valenzstrichformel von Joane Dotten
Der nachfolgende Link führt zu einer externen Internetseite, die ggf. andere Datenschutzvorgaben erfüllt als wir es auf dieser Plattform tun. Dabei können Daten von dir übertragen und weiterverarbeitet werden. Wenn du dich allgemein zum Thema Datenschutz erkundigen möchtest, empfehlen wir dir die Erklärvideos der Initiative Datenschutz geht zur Schule.Beherrscht du also die Lewis-Schreibweise, sollte die Valenzstrichformel ein Klacks für dich sein! 😎 Solltest du dennoch mal nicht weiter wissen, kannst du den folgenden Strukturformelzeichner nutzen. Dann lass uns jetzt mit der Skelettformel weiter machen! 😋
Skelettformel
Du fragst dich, wie man diese beiden Schreibweisen nochmal zu einer neuen Schreibweise abwandeln kann? Tatsächlich vereinfacht die Skelettformel 💀 die Darstellung von Molekülstrukturen sogar noch ein wenig mehr als die Lewis-Schreibweise und die Valenzstrichformel. Sie erleichtert das Aufschreiben von komplizierten und langen Molekülen, wird jedoch ausschließlich bei organischen Verbindungen verwendet. Ihren Namen hat diese Schreibweise, weil sie das sogenannte Kohlenstoffgerüst aufzeigt. Alle Verbindungen der Kohlenstoffatome bilden also das Skelett des Moleküls. Dabei werden Bindungslinien in einer Zickzackform dargestellt und die Kohlenstoffatome sitzen an jeder Ecke zwischen zwei Linien und an jedem Endpunkt einer Linie. Die Kohlenstoffatome werden dafür aber nicht extra aufgeschrieben, sondern du weißt einfach dass sie da sind und denkst sie dir nur 💭. Da Wasserstoffatome die häufigsten Bindungspartner der Kohlenstoffatome sind, werden sie ebenfalls nicht eingezeichnet. Klingt alles noch ein wenig abstrakt und schwer vorstellbar? 😯 Sehen wir uns zur Einfachheit mal Propan an.
Propan hat drei Kohlenstoffatome und acht Wasserstoffatome. Wie du weißt ist Kohlenstoff vierbindig und Wasserstoff braucht zur Edelgaskonfiguration lediglich ein weiteres Elektron. Das würde in der Valenzstrichformel zunächst so aussehen:
Propan als Valenzstrichformel von Joane Dotten
Jetzt wollen wir das ganze aber weiter vereinfachen. Daher denken wir uns sowohl die Kohlenstoffatome an den Ecken und zwischen den Strichen weg als auch die gebundenen Wasserstoffatome. Das ergibt dann die deutlich vereinfachte Skelettformel:
Propan als Skelettformel von Joane Dotten
Auch Doppel- und Dreifachbindungen lassen sich mit der Skelettformel darstellen. Dafür werden einfach noch Striche an passender Stelle hinzugefügt. Das wäre zum Beispiel bei Essigsäure (C2H4O2) der Fall. Kohlenstoff ist wieder vierbindig, Wasserstoff sucht noch ein Elektron als Partner und Sauerstoff ist zweibindig. Daraus ergibt sich folgende Skelettformel:Essigsäure als Skelettformel von Joane Dotten
Der Kohlenstoff am linken Ende geht also eine Verbindung mit drei Wasserstoffatomen und einem Kohlenstoffatom ein. Das Kohlenstoffatom in der Mitte geht, neben dem anderen Kohlenstoffatom, eine Doppelbindung mit einem Sauerstoffatom und eine Verbindung mit einer OH-Gruppe ein. Alle vier "Arme" 💪🏽 der Kohlenstoffatome sind demnach jeweils besetzt. Die Skelettformel kann aber auch die Form eines Rings einnehmen. Das ist beispielsweise bei Benzol (C6H6) der Fall. Jedes Kohlenstoffartom besitzt eine Doppelbindung und eine Einfachbindung zu einem anderen Kohlenstoffatom. Außerdem wird die vierte Bindung mit einem Wasserstoffatom eingegangen.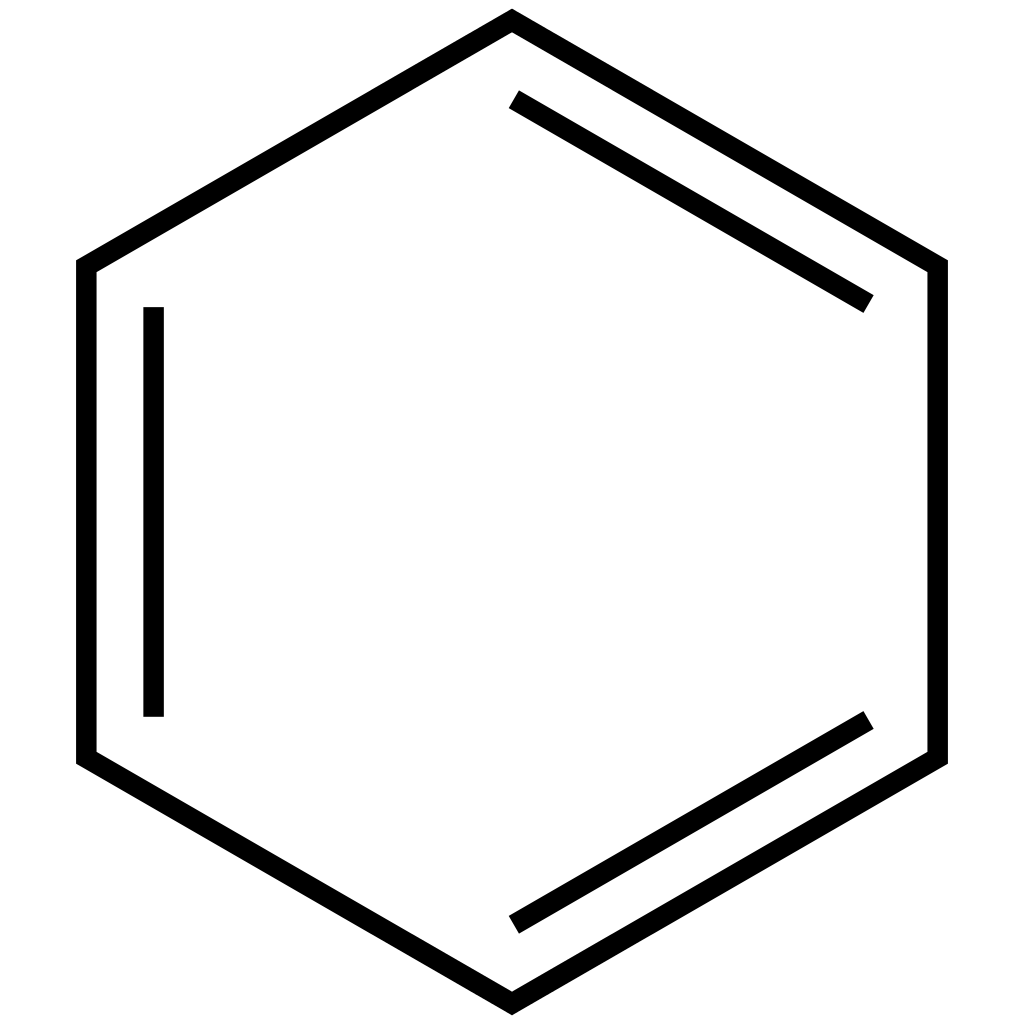 Benzol szerkezete von Pa-Gyula ist lizenziert unter einer Creative Commons Namensnennung - Weitergabe unter gleichen Bedingungen 4.0 International Lizenz.
Benzol szerkezete von Pa-Gyula ist lizenziert unter einer Creative Commons Namensnennung - Weitergabe unter gleichen Bedingungen 4.0 International Lizenz.
Du siehst also, wenn du die Anzahl an Kohlenstoffen kennst, ist es ein Leichtes diese als verbundene Striche zu zeichnen. Jedoch kommt auch die Skelettformel mal an ihre Grenzen. Denn es können ausschließlich organische Moleküle mittels der Skelettformel abgebildet werden und auch nur dann wenn sie mehr als ein Kohlenstoffatom besitzen. Organische Moleküle mit nur einem Kohlenstoffatom, wie z.B. Methan (CH4), können nämlich nicht dargestellt werden. Jetzt bist du fit im Lesen und Zeichnen von Molekülstrukturen! Also ran an die Übungsaufgaben! 😉
-
Einteilung der Kohlenwasserstoff-Verbindungen
Wie du bereits gelernt hast, bestehen Kohlenwasserstoffe ausschließlich aus Kohlenstoff- und Wasserstoffatomen. Kohlenwasserstoff-Verbindungen lassen sich jedoch unterteilen. Die häufigsten Kohlenwasserstoff-Verbindungen sind sogenannte aliphatische Kohlenwasserstoffe, wie z.B. Alkane, Alkene und Alkine. Aber auch Aromaten gehören zu den Kohlenwasserstoffen.Aber fangen wir ganz am Anfang an. Zunächst lassen sich Kohlenwasserstoffe in zyklisch und azyklisch unterteilen. Zyklisch soll dabei gleichbedeutend zu ringförmig sein und azyklisch zu kettenförmig. Doch bei dieser Unterteilung bleibt es nicht. Die zyklischen Kohlenwasserstoffe lassen sich weiter in alizyklisch (aliphatisch) und aromatisch aufbröseln. Aliphatisch sind all diejenigen Kohlenwasserstoffe, die nicht aromatisch sind. Die aromatischen Kohlenwasserstoffe erkennst du aber anhand ihres aromatischen Rings. Die alizyklischen Kohlenwasserstoffe sind die Cycloalkane, wohingegen die aromatischen Kohlenwasserstoffe die Cycloalkene sind. Aber auch die azyklischen Kohlenwasserstoffe werden weiter in gesättigt, das sind die Alkane, und ungesättigt, in Alkene und Alkine, unterschieden. Die Übersicht zur Unterteilung der Kohlenwasserstoffe habe ich dir auch nochmal in der nachfolgenden Abbildung zusammen gefasst 😊
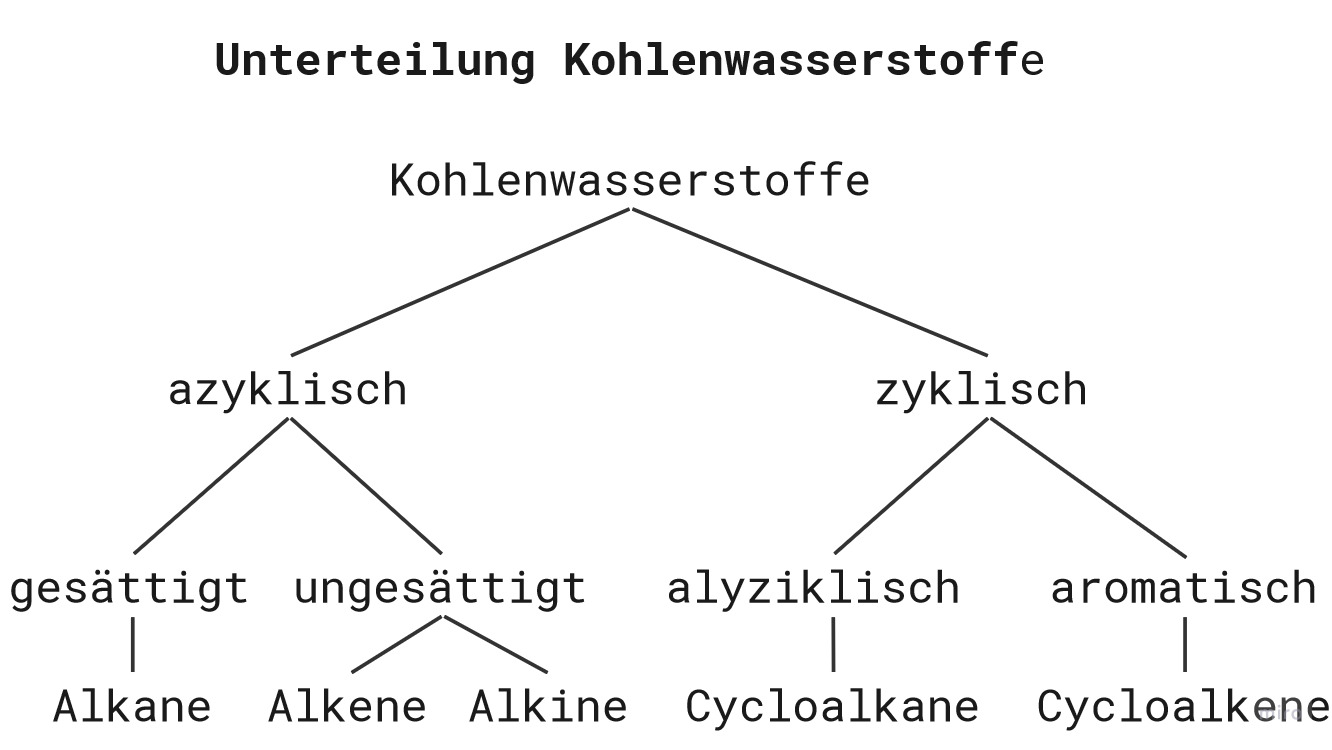
Unterteilung der Kohlenwasserstoffe von Joane Dotten
Schauen wir uns doch zunächst mal die Alkane genauer an 🧐. Da Alkane gesättigte Kohlenwasserstoffe sind, enthalten sie nur Einfachbindungen. Außerdem kannst du dir merken, dass alle Alkane auf -an enden, wie z.B. Methan (CH4). Fügst du zum Methan jetzt eine weitere CH2-Gruppe hinzu, erhälst du Ethan (C2H6). Machst du dies immer weiter, erhälst du die komplette Reihe an Alkanen. Du kannst dir also merken, dass die allgemeine Form der Alkane CnH2n+2 ist. Der Vollständigkeit halber habe ich dir trotzdem alle wichtigen Alkane und ihre Summenformel zusammen gestellt 😋:
Alkan Summenformel Methan CH4 Ethan C2H6 Propan C3H8 Butan C4H10 Pentan C5H12 Hexan C6H14 Heptan C7H16 Octan C8H18 Nonan C9H20 Decan C10H22
Dann kommen wir doch mal zu den Alkenen und Alkinen. Da sie zu den ungesättigten Kohlenwasserstoffen gehören, haben sie Mehrfachbindungen. Dabei enthalten die Alkene mindestens eine oder sogar mehrere Doppelbindungen und enden auf -en. Wie zum Beispiel Ethen, auch Ethylen, (C2H4). Die Alkine enthalten sogar mindesten eine oder sogar mehrere Dreifachbindungen und enden auf -in. Wie zum Beispiel Ethin, auch Acetylen, (C2H2). Meist steht vor den Alkenen bzw. Alkinen eine Zahl, die angibt, an welcher Stelle sich die Doppel- oder Dreifachbindung befindet. Wenn wir uns dazu beispielsweise 1-Hexen ansehen, handelt es sich um eine Doppelbindung am ersten C-Atom. Bei 4-Hexin handelt es sich um eine Dreifachbindung am vierten C-Atom. Genauso wie bei den Alkanen haben auch die Alkene und Alkine eine allgemeine Form: Alkene CnH2n; Alkine CnH2n-2. Anbei habe ich dir aber auch hier wieder die wichtigsten Alkene und Alkine und deren Summenformeln zusammengestellt 😊:Alkene Summenformel Alkine Summenformel Ethen C2H4 Ethin C2H2 Propen C3H6 Propin C3H4 1-Buten C4H8 1-Butin C4H6 1-Penten C5H10 1-Pentin C5H8 1-Hexen C6H12 1-Hexin C6H10 1-Hepten C7H14 1-Heptin C8H12 1-Octen C8H16 1-Octin C10H14 1-Nonen C9H18 1-Nonin C12H16 1-Decen C10H20 1-Decin C14H18
Last but not least: aromatische Kohlenwasserstoffe! 👈 Die besitzen in der Regel C6-Ringe, also 6 Kohlenstoffatome in einem Ring angeordnet. Du erinnerst dich doch noch an den Benzolring oder? 🤔 Außerdem sind die Aromaten planar, das heißt alle Atome liegen in der gleichen Ebene und sind flach angeordnet. Kohlenwasserstoffe sind ebenfalls als konjugiertes Doppelbindungs-System definiert. Du verstehst nur Bahnhof? 🤯 Lass es mich einfacher ausdrücken: Entweder besitzt der aromatische Kohlenwasserstoff mehrere Doppelbindungen, die jeweils durch nur eine Einfachbindung getrennt sind. Oder aber der Aromat besitzt eine oder mehrere Doppelbindungen, welche durch positiv oder negativ geladene Kohlenstoff- bzw. Heteroatome getrennt sind. Die einfachsten und gängigsten Aromaten sind Benzol (C6H6) und Toluol (C7H8). Die beiden solltest du dir merken! ☝️😇 -
Die funktionellen Gruppen
Die sogenannten funktionellen Gruppen sorgen bei organischen Molekülen dafür, dass die Eigenschaften und das Reaktionsverhalten maßgeblich beeinflusst werden. Dies kann unter anderem den Siedepunkt oder die Löslichkeit einer organischen Verbindung bedingen. Funktionelle Gruppen bestehen in der Regel immer noch aus Kohlenstoffatomen, aber die Wasserstoffatome werden entweder durch Sauerstoff-, Stickstoff- oder, in seltenen Fällen, Schwefelatomen oder sogar durch Atomgruppen ersetzt. Außerdem werden organische Verbindungen, die die gleiche funktionelle Gruppe im Molekül haben und dadurch sehr ähnliche Eigenschaften, zu einer Stoffklasse zusammengefasst. Ein Molekül kann aber auch mehrere funktionelle Gruppen besitzen 😊.
Zur Unterteilung der funktionellen Gruppen kannst du dir bereits folgendes merken: es gibt einmal die Gruppen mit Heteroatomen und die Gruppen ohne Heteroatome. Als Heteroatome können hier Sauerstoffatome, Stickstoffatome, Schwefelatome sowie Phosphoratome und Halogene gemeint sein. Die Gruppen, die keine Heteroatome besitzen, haben dafür aber meist Doppel- oder Dreifachbindungen zwischen den Kohlenstoffatomen. Allerdings werden die Verbindungen ohne Heteroatome oft nicht als funktionelle Gruppe anerkannt, da sie keine zusätzlichen Atome beinhalten und lediglich ein Strukturmerkmal abbilden 😥.
Werden wir jetzt mal ein wenig konkreter. Du weißt bereits, dass das Grundgerüst einer organischen Verbindung immer aus einer Kohlenstoffatom-Kette besteht. Alle funktionellen Gruppe können dann Bindung mit einem beliebigen Kohlenstoffatom eingehen. Dabei wird zwischen primären, sekundären und tertiären funktionellen Gruppen unterschieden. Die Bezeichnung hat nichts mit der funktionellen Gruppe selbst zu tun, sondern viel mehr mit dem Kohlenstoffatom mit dem die Gruppe eine Verbindung eingegangen Um die richtige Bezeichnung zu finden, musst du lediglich schauen, ob das Kohlenstoffatom, mit dem die funktionelle Gruppe eine Bindung eingegangen ist, einen, zwei oder mehrere Reste hat. Unter Rest versteht sich hierbei eine Verbindung zu anderen Atomen außer zu Wasserstoff. Es ist hierbei aber egal, wie viele weitere Atome dort gebunden sind bzw. wie "groß" der Rest ist. Hat das Kohlenstoffatom also nur einen Rest und zwei Wasserstoffatome, handelt es sich um eine primäre funktionelle Gruppe. Besitzt das Kohlenstoffatom zwei Reste und ein Wasserstoffatom, dann ist es eine sekundäre funktionelle Gruppe und wenn an das Kohlenstoffatom nur Reste, aber kein Wasserstoffatom gebunden sind, ist es immer eine tertiäre funktionelle Gruppe. Das klingt doch ganz simpel oder? 🤓Falls dir das doch noch nicht ganz klar ist 😳, schauen wir uns dazu nochmal ein Beispiel an: Methanol hat die Strukturformel CH3OH. Es befindet sich also eine OH-Gruppe (der Alkohol) an einem C-Atom, welches ansonsten nur Bindungen mit H-Atomen eingegangen ist. Es handelt sich hierbei also um eine primäre funktionelle Gruppe bzw. einen primären Alkohol.
Jetzt möchte ich dir noch die 4️⃣ wichtigsten funktionellen Gruppen an die Hand geben. Das sind die Gruppen Aldehyd, Alkohol, Carbonsäure und Ester. Von der einen oder anderen hast du mit Sicherheit schonmal gehört. Aber starten wir erstmal mit Aldehyd. Die Aldehyde kannst du an der sogenannten Cabonylgruppe (C=O) erkennen. Die Carbonylgruppe geht dabei eine Verbindung mit mindestens einem Wasserstoffatom ein, so dass die Aldehydgruppe (H-C=O) entsteht. Außerdem enden alle Aldehyde auf -al. Ist das Grundgerüst jetzt Methan, welches eine Carbonylgruppe (C=O) besitzt, wird daraus Methanal (CH2O) (auch bekannt unter dem Namen Formaldehyd). Das Kohlenstoffatom ist also eine Doppelbindung mit dem Sauerstoffatom eingegangen und jeweils eine Einfachbindung mit den Wasserstoffatomen. Kommen wir zu den daraus resultierenden Eigenschaften. Die Carbonylgruppe ist polar, hat jedoch eine geringere Polarität als Alkohol. Daher liegen die Schmelz- und Siedepunkte auch unterhalb der von Alkohol. Trotzdem lassen sich Aldehyde gut in Wasser 💧 lösen.
Bei Alkoholen ist die funktionelle Gruppe die Hydroxylgruppe (-OH). Hier bildet sich der Name des Alkohols ebenfalls aus dem Grundgerüst, jedoch mit der Endung -ol zusammen. Haben wir also Ethan als Grundgerüst mit Verbindung zu einer Hydroxygruppe, ist die richtige Bezeichnung Ethanol (C2H6O). Wie die Carbonylgruppe, ist auch die Hydroxylgruppe polar. Dadurch können sich Wasserstoffbrückenbindungen zwischen Methanolmolekülen bilden. Die Wasserstoffbrückenbindungen sind unter anderem dafür verantwortlich, dass Alkohol flüssig ist. Aber sie sorgen auch für einen höheren Siede- und Schmelzpunkt, sowie die Löslichkeit in Wasser 💧.
Carbonsäuren sind anhand ihrer Carboxylgruppe (-COOH) zu erkennen. Der Name der Carbonsäure bildet sich aus dem Grundgerüst und aus der Endung -säure. Nehmen wir als Grundgerüst Butan und dazu die Carboxylgruppe bekommen wir die sogenannte Butan- bzw. Buttersäure 🧈(C4H8O2). Durch die Carboxylgruppe wird ein H+-Ion freigesetzt, wodurch die Acidität (Säuregrad der Flüssigkeit) der ganzen Verbindung erhöht wird. Auch hier sorgt die Polarität wieder für eine Erhöhung der Siede- und Schmelzpunkte, sowie die Wasserlöslichkeit 💧.
Last but not least: die funktionelle Gruppe Ester! Ester werden durch die Veresterung gebildet. Dafür bedarf es lediglich einer Säure und eines Alkohols. Ein gutes Beispiel ist hierfür das Produkt Carbonsäureester mit der funktionellen Estergruppe (-COOR), gebildet durch die Reaktion von Carbonsäure mit einem Alkohol. Auch Ester haben die Eigenschaft polar zu sein. Dies ist wegen der Elektronegativitätsdifferenz von Kohlenstoff und Sauerstoff der Fall. Daher kommt es, ebenso wie bei den anderen genannten funktionellen Gruppen, zu erhöhten Schmelz- und Siedepunkten und häufig zu einer guten Wasserlöslichkeit 💧.
Der Übersicht halber, habe ich dir alle vier funktionellen Gruppen nochmal in einer Tabelle zusammengefasst 💫:
Stoffgruppe Funktionelle Gruppe Halbstrukturformel Aldehyd Aldehydgruppe R-COH Alkohol Hydroxygruppe R-OH Carbonsäure Carboxygruppe R-COOH Carbonsäureester Estergruppe R1-COO-R2 Der nachfolgende Link führt zu einer externen Internetseite, die ggf. andere Datenschutzvorgaben erfüllt als wir es auf dieser Plattform tun. Dabei können Daten von dir übertragen und weiterverarbeitet werden. Wenn du dich allgemein zum Thema Datenschutz erkundigen möchtest, empfehlen wir dir die Erklärvideos der Initiative Datenschutz geht zur Schule.Es gibt aber noch deutlich mehr funktionelle Gruppen. Diese kannst du dir hier ansehen. -
Konstitutionsisomere
Es gibt chemische Verbindungen mit derselben Summenformel und der gleichen Molekülmasse, sie unterschieden sich lediglich in ihrer Strukturformel. Diese chemischen Verbindungen werden als Isomere bezeichnet. Isomere sind also Stoffe, dessen Anteil aus der gleichen Art und Anzahl an Atomen bestehen. Es wird zwischen mehreren Formen der Isomerie entschieden und zwar gibt es einmal die Konstitutionsisomerie, bei der die Verknüpfung der Atome bei gleicher Summenformel anders ist, und die Stereoisomerie, bei der ebenfalls die Summenformel gleich ist, sich dafür aber die räumliche Anordnung der Atome unterscheidet. Dadurch kommt es zu verschiedenen physikalischen und chemischen Eigenschaften☝️.
Wir wollen uns hier intensiver mit den Konstitutionsisomeren befassen. Diese haben, wie bereits oben erwähnt, die gleiche Summenformel und weichen lediglich in ihrem strukturellen Aufbau voneinander ab. Die Konstitutionsisomeren können wieder in unterschiedliche Untergruppen unterteilt werden. Es gibt Funktionsisomere, Skelettisomere, Stellungsisomere und Bindungsisomere.
Bei der Funktionsisomerie besitzen zwei Stoffe die gleiche Summenformel, haben aber unterschiedliche funktionelle Gruppen. Ein recht bekanntes Beispiel für die Funktionsisomerie sind Ethanol und Dimethylether mit der Summenformel C2H6O. Ethanol ist ein Alkohol mit der Hydroxygruppe -OH, während Dimethylether ein Ether mit zwei Methylgruppen als organischer Rest (R1-O-R2) ist. Damit du dir den Unterschied zwischen dem Aufbau der beiden Stoffe besser vorstellen kannst, habe ich dir die Beiden nochmal aufgezeichnet 😊:
Funktionsisomerie anhand des Beispiels Ethanol und Dimethylether von Joane Dotten Kommen wir jetzt zur Skelettisomerie. Skelettisomere haben ebenfalls wieder die gleiche Summenformel, jedoch haben sie verscheiden verzweigte Kohlenstoffgerüste. Das kommt vor allem bei organischen Stoffgruppen wie den Alkanen vor. Ein bekanntes Beispiel hierfür ist 1-Butanol und 2-Methyl-1-propanol (C4H10O). Damit du den Unterschied zwischen den beiden Kohlenstoffgerüsten siehst, habe ich dir etwas vorbereitet 🤭:
Skelettisomerie anhand des Beispiels 1-Butanol und 2-Methyl-1-propanol von Joane Dotten Kommen wir zur Stellungsisomerie. Beide Stoffe besitzen die gleiche Summenformel und die gleiche funktionelle Gruppe. Jedoch befinden sich die funktionellen Gruppen an unterschiedlichen Stellen in der chemischen Verbindung. Keine Sorge, auch hier habe ich dir wieder ein Beispiel zur Anschauung mitgebracht und zwar 1,2-Propanidol und 1,3-Propanidol mit der Summenformel (C3H8O2). Bei Beiden handelt es sich um Alkohole mit einer Hydroxygruppe (-OH) 🤯.
Stellungsisomerie anhand des Beispiels 1,2-Propanidol und 1,3-Propanidol von Joane Dotten Die letzte Untergruppe der Konstitutionsisomere ist die der Bindungsisomere. Die Bindungsisomere unterscheiden sich in der Anzahl und/oder der Position der
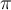 - und
- und 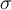 -Bindungen. Als Beispiel ist hier Propadien und Propin (C3H4) zu nennen. Während Propadien zwei Doppelbindungen besitzt, hat Propin eine Dreifachbindung.
-Bindungen. Als Beispiel ist hier Propadien und Propin (C3H4) zu nennen. Während Propadien zwei Doppelbindungen besitzt, hat Propin eine Dreifachbindung. Bindungsisomerie anhand des Beispiels Propadien und Propin von Joane Dotten So, jetzt kennst du dich richtig gut mit Kostitutionsisomeren aus! Das einzige was ich dir noch mit auf den Weg geben möchte, ist folgendes: Je mehr Atome eine Verbindung besitzt, desto mehr mögliche Konstitutionsisomere gibt es auch! 😄
-
Nomenklatur
Du hast dich doch sicherlich schon gefragt, wie Stoffe wie beispielsweise 2-Methyl-1-propanol eigentlich an ihren Namen kommen 🤔. Die Namen unterliegen festen Regeln und gelten sogar international. All dies ist in der IUPAC (International Union of Pure and Applied Chemistry) geregelt und wird als systematische Nomenklatur bezeichnet. Hast du also den Namen eines Stoffes wie zum Beispiel Methanol, dann weißt du, dass es sich um das Molekül CH3OH handelt und kannst daraus die zugehörige Strukturformel ableiten. Insgesamt musst du drei Schritten folgen, wenn du ein Molekül benennen möchtest.
- 1. Schritt: Bestimme die Hauptkette bzw. den Stamm in der Verbindung.
- Es gilt Ring vor Kette.
- Höchste Funktionalität in der längsten Kette.
- Größte Anzahl an Substitutionen in längster Kette.
- Höchste Funktionalität bekommt kleinste Nummer.
- Alle Substituenten sollen möglichst kleine Nummer erhalten.
- Substituenten benennen.
- Die Position des Substituenten wird durch die Nummer des Kohlenstoffatoms an das diese gebunden sind angegeben.
- Gibt es mehrere gleiche Substituenten wird die Position durch ein Komma getrennte Zahlen angegeben. Je nach Anzahl der Substituenten wird als Vorsilbe ein griechisches Zahlenwort (di- tri-, tetra-, etc.) hinzugefügt.
- Die Substituenten werden in alphabetischer Reihenfolge sortiert.
- Nummern und Buchstaben werden durch einen Bindestrich getrennt.
- Nur der erste Buchstabe wird groß geschrieben.
- Funktionelle Gruppen wie zum Beispiel Alkohole werden nur im Stammnamen genannt (mit -ol, -al, …), wenn sie die höchste Priorität haben. Ansonsten werden sie mit dem entsprechenden Substituentennamen bezeichnet.
Das erscheint jetzt alles vielleicht ein bisschen viel, daher gehen wir alles Schritt für Schritt anhand eines Beispielmoleküls, welches du bereits unten sehen kannst, durch. Schauen wir uns dazu Schritt 1️⃣ genauer an. Du musst zunächst einmal die Hauptkette in deinem Molekül finden. Bei Alkanen ist dies die längste, ununterbrochene Kette aus Kohlenstoffatomen. Wenn dir die Namen zu den Alkanen nicht mehr einfallen, kannst du unter "Einteilung der Kohlenwasserstoff-Verbindungen" nochmal nachsehen. Handelt es sich jedoch um ein Molekül mit funktionellen Gruppen, muss die Funktionalität mit der höchsten Priorität in der längsten Kette sein und nicht unbedingt die Kette mit den meisten Kohlenstoffatomen. Dadurch wird die Verbindungsklasse der Verbindung bestimmt. Wenden wir das doch mal an unserem Beispielmolekül an: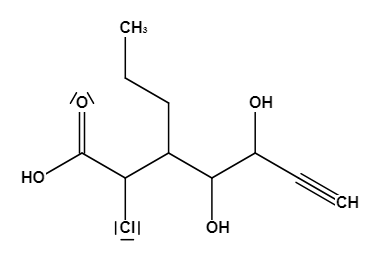
Beispielmolekül mit http://www.strukturformelzeichner.de/ erstellt Da wir keinen Ring im Molekül haben, musst du also die längste zusammenhängende Kohlenstoffkette finden oder aber, falls funktionelle Gruppen vorhanden sind, die mit der höchsten Priorität. Damit du immer weißt, welche funktionelle Gruppe die höchste Priorität hat, habe ich dir dazu eine Tabelle zusammengestellt. Selbstverständlich steht oben die Gruppe mit der höchsten Priorität, welche von oben nach unten abnimmt:
Im Beispielmolekül befindet sich also eine Carbonsäure, welche die höchste Priorität hat und somit in der längsten Kette enthalten sein muss. Daher wissen wir bereits dass der Stammname die Endung -säure bekommt.Verbindungsklasse Formel Stammname Beispiel Carbonsäure R-C(O)H "Stamm"säure Carbonsäure Ester R-C(O)R "Stamm"säure-"R-Gruppe"ylester Propansäureethylester Aldehyde R-CHO "Stamm"al Ethanal Ketone RRC=O "Stamm"on Propanon Alkohole R-OH "Stamm"ol Ethanol Alkene CnH2n-2 "Stamm"en Ethen Alkine CnH2n "Stamm"in Ethin Alkane CnH2n+2 "Stamm"an Ethan 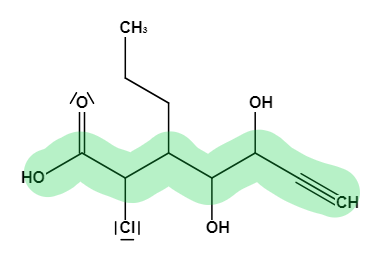
Beispielmolekül mit markierter längster Kette von Joane Dotten Gehen wir weiter zu Schritt 2️⃣. Die Nummerierung der Hauptkette. Da die Carbonsäure die Gruppe mit der höchsten Funktionalität ist, bekommt diese auch die möglichst kleinste Nummer. Danach wird der Reihe nach weiter durchnummeriert. Du solltest also am Ende die Carbonsäure mit der Nummer 1️⃣ versehen und insgesamt 7️⃣ Kohlenstoffatome nummeriert haben. Das Ganze sieht dann wie folgt aus: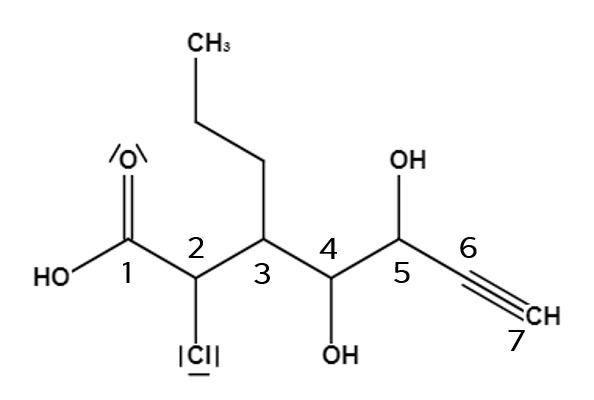
Beispielmolekül mit nummerierter Hauptkette von Joane Dotten
Für den Stammnamen haben wir dadurch bereits wieder einige Informationen gesammelt. Die längste Kette enthält sieben Kohlenstoffatome, wodurch ein -hept im Stammnamen enthalten sein muss, und eine Carbonsäuregruppe wie wir bereits wissen. Da aber auch Mehrfachbindungen für den Stammnamen berücksichtigt werden müssen, müssen wir uns die Dreifachbindung genauer ansehen. Die Position der Mehrfachbindung wird mit der Nummer angegeben an der diese beginnt. In diesem Fall also die sechs. Außerdem müssen zwischen den Zahlen und Buchstaben immer Bindestriche stehen. Der Stammname ergibt sich somit schonmal zu -hept-6-insäure. Das -in kommt natürlich von der Dreifachbindung, wie du bestimmt noch aus "Einteilung der Kohlenwasserstoff-Verbindungen" weißt! 😎Kommen wir nun zum 3️⃣ und letzten Schritt zur Benennung eines Moleküles. Es müssen zunächst die Substituenten benannt werden. Davon gibt es insgesamt drei in diesem Molekül. Zwei Alkoholgruppen, ein Chloratom und eine Kette aus drei Kohlenstoffatomen. Diese habe ich dir in folgender Abbildung eingekreist:
Beispielmolekül mit eingekreisten Substituenten von Joane Dotten Die Substituenten haben wir also schonmal gefunden. Genau wie bei der Mehrfachbindung wird ihre Position durch die Nummer des Kohlenstoffatoms angegeben an das sie gebunden sind. Für Chlor lautet die Zahl also 2, für die Kohlenstoffkette 3 und die beiden Alkohole 4 und 5. Da es sich bei den Alkoholen um mehrere gleiche Substituenten handelt, werden die Positionen durch mit einem Komma getrennten Zahlen angegeben und die Anzahl der gleichen Substituenten durch ein griechisches Zahlenwort (di-, tri- tetra., etc.) nach der Position und vor dem Substituentennamen angegeben. Die Vorsilbe für die beiden Alkohole lautet also di. Zudem werden funktionelle Gruppen nur im Stammnamen genannt, wenn sie die höchste Priorität haben. Das ist in diesem Fall die Carbonsäure. Doch wie finden wir jetzt die passenden Namen für die Substituenten raus? Keine Sorge, auch dafür habe ich eine Tabelle vorbereitet, die in solchen Fällen greift:
Verbindungsklasse Substituentenname Carbonsäure Carboxy- Aldehyd Formyl- Keton Oxo- Alkohol Hydroxy- Alken "Gruppe"-enyl Alkin "Gruppe"-inyl Alkan "Gruppe"-anyl Halogenverbindung Halogen-
Die beiden Alkoholgruppen werden also im Molekülnamen mit Hydroxy- angegeben. Mit Ihren Zahlen und der Vorsilbe ergibt das 4,5-dihydroxy. Während das Chloratom beim Namen Chlor bleibt und sich so 2-chlor ergibt. Die Alkylkette mit den drei Kohlenstoffatomen bekommt an das -prop noch die Endung -yl. Zusammen mit der Position drei ergibt sich 3-propyl. Die Substituenten werden im Molekülnamen nach ihrer alphabetischer Reihenfolge sortiert. Also erst 2-Chlor (daher auch großgeschrieben), dann 4,5-hydroxy und zum Schluss 3-propyl. Fügen wir das alles mit dem Teil (-hept-6-insäure) zusammen den wir bereits kennen, erhalten wir den Molekülnamen:2-Chlor-3-propyl-4,5-dihydroxy-hept-6-insäure!Werden die drei Schritte und ihre Regeln befolgt, ist das Ganze gar nicht so schwer. Vielleicht ist dir auch aufgefallen, dass wir den Molekülnamen von rechts nach links gebildet haben. Du kannst dir im Bezug auf Benennung von Molekülen demnach folgendes merken: Das Pferd wird immer von hinten aufgezäumt! 🐎😄 - 1. Schritt: Bestimme die Hauptkette bzw. den Stamm in der Verbindung.
