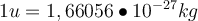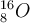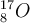Atomaufbau
Abschnittsübersicht
-
Das folgende Modul soll dir alles rund um das Atom näher bringen. Unter anderem beschäftigen wir uns mit dem Kern-Hülle-Modell und dem Schalenmodell. Du wirst außerdem unterschiedliche Bindungstypen kennenlernen, ebenso wie die Oktettregel. Viel Spaß! 😊
Nach der Bearbeitung des Moduls solltest du:
- Den Begriff Atom definieren können
- Protonen & Neutronen als Bestandteile des Atomkerns kennen
- Erkennen, was Isotope der verschiedenen chemischen Elemente unterscheidet
- Das Schalenmodell der Hülle erläutern & darstellen können
- Die Begriffe Ordnungszahl und Massenzahl erläutern und sie in Bezug auf das PSE einordnen können
- Die relative Atommasse der Elemente und die Masseneinheit 1 u definieren können
- in der Lage sein das Orbitalmodell zu beschreiben
Und nun noch schnell ein paar Infos bevor es losgeht: Das Modul ist so aufgebaut, dass du mit dem Eingangstest starten solltest. Auf Basis dessen bekommst du von uns eine Empfehlung, mit welchem Level der Übungen du in den jeweiligen Themen fortfahren solltest. Unabhängig von unserer Empfehlung kannst du aber auch jederzeite andere Übungen mitmachen und dich in diesem Modul völlig frei bewegen! Zum Schluss solltest du allerdings den Abschlusstest nicht vergessen! Dieser ermöglicht es dir dein Wissen anzuwenden und gibt dir noch einmal Feedback 💪
Die Bearbeitunsgdauer für das gesamte Modul kann bis zu 2 Stunden betragen ⌛️ Bitte lass dich davon nicht abschrecken sondern lies noch kurz weiter 😜 Unsere Zeitangabe basiert auf einer ungefähren Einschätzung und der Annahme, dass du dir alle Inhalte ansiehst und jede einzelne Aufgabe bearbeitest. Du kannst aber natürlich selber frei entscheiden wann du dir welche Inhalte anguckst und das Modul jederzeit verlassen, wieder zurückkommen und dort weitermachen wo du aufgehört hast ⏯-
Die wichtigsten Atommodelle im Überblick (Teil 1)
Die Atommodelle sollen Aufschluss über den Aufbau und die Form des Atoms geben, jedoch haben sich die Vorstellungen, wie ein Atom aufgebaut ist, mit der Zeit verändert. Du hast wahrscheinlich im Chemieunterricht schon mehrere Atommodelle kennengelernt. Auch hier im Kurs sollen dir die wichtigsten Atommodelle nochmal etwas näher gebracht werden. Also auf geht's! 🎉
Tatsächlich wurde sich bereits im 5. Jahrhundert vor Christus mit Atomen beschäftigt. Der Philosoph Demokrit war überzeugt davon, dass Stoffe aus festen, unteilbaren Teilchen bestehen. Diese unteilbaren Teilchen wurden als Atome bezeichnet, tatsächlich bedeutet der Begriff "atomos" im Griechischen übersetzt das "Unteilbare".
Der Chemiker John Dalton erweiterte das Atommodell von Demokrit Anfang des 19. Jahrhunderts. Daltons Modell ist auch bekannt unter dem Namen Kugelteilchenmodell. Auch er war der Meinung, das ein Atom die kleinste, unteilbare Einheit der Materie ist. Der entscheidende Unterschied der beiden Modelle war, dass Dalton zu dem Entschluss kam, Atome können verschieden sein und sich in ihrer Masse und ihrem Volumen unterscheiden. Der Punkt mit der unterschiedlichen Masse und dem unterschiedlichen Volumen gilt jedoch nur für Atome verschiedener Elemente, Atome des gleichen Elements unterscheiden sich nicht in Masse und Volumen. Daltons Atommodell besagt außerdem, dass Atome bei chemischen Reaktionen weder vernichtet noch erzeugt werden können. Jedoch werden die Atome der Ausgangsstoffe bei chemischen Reaktionen neu angeordnet.
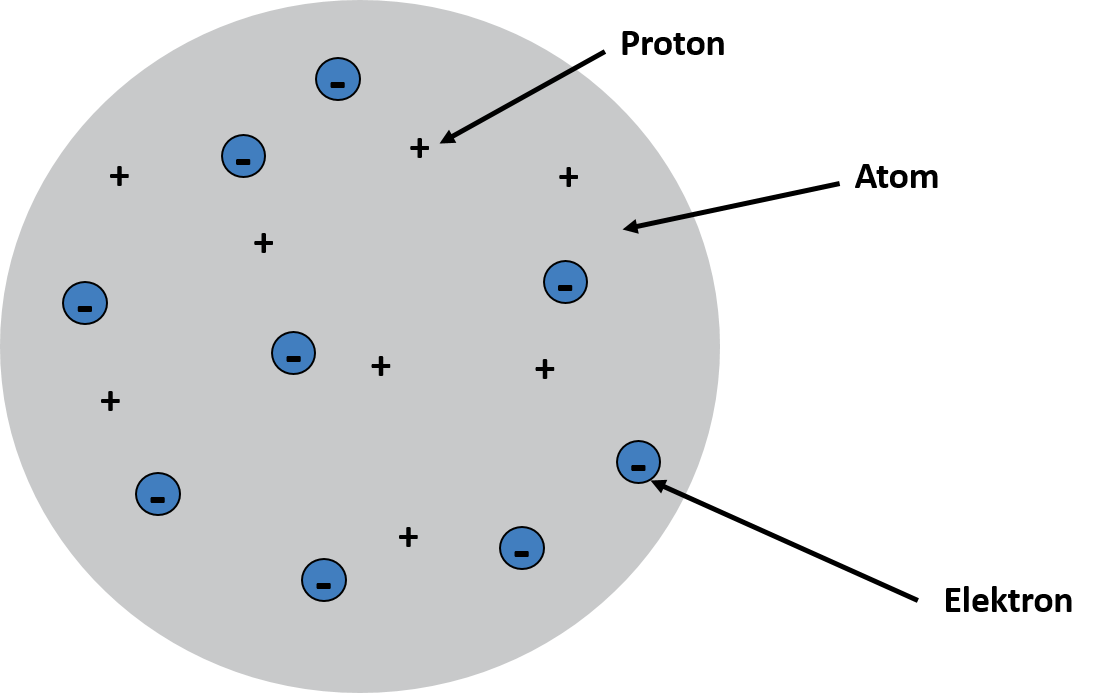
Ende des 19. Jahrhunderts machte Joseph Thomson bei seinem Experiment mit einer Glühkathode folgende Entdeckung: Beim Erhitzen verlassen Elektronen Metalle. Dabei konnte er noch eine Erkenntnis über die Masse der Elektronen gewinnen, sie haben eine etwa 2000 Mal kleinere Masse als Wasserstoffatome (H2). Mit seinem Atommodell, welches auch als Rosinenkuchenmodell bekannt ist, revidierte er die Aussage von Demokrit und Dalton, Atome seien die kleinste, unteilbare Einheit. Laut Thomson haben Atome eine gleichmäßig verteilte, positive Masse, sind selbst aber elektrisch neutral. Die negativ geladenen Elektronen bewegen sich verstreut im Atom selbst und können entweder vom Atom aufgenommen oder abgegeben werden. Bei der Aufnahme und Abgabe von Elektronen entstehen aus den Atomen sogenannte Ionen. Ionen sind also elektrisch geladene Atome oder Moleküle. Je nach Anzahl der positiven Protonen oder negativen Elektronen, entsteht die positive oder negative Ladung des Ions. Das Rosinenkuchenmodell ist in der nachfolgenden Grafik nochmal dargestellt:
Atommodell nach Thomson von Joane Dotten Bereits nach einigen Jahren erweiterte Ernest Rutherford ebenfalls mit Hilfe eines Experiments Thomsons Rosinenkuchenmodell. Das Experiment beinhaltete eine dünne Goldfolie, die Rutherford mit Alphateilchen beschoss. Dabei stellte er fest, dass nur ein kleiner Teil der Alphateilchen auf einem Schirm reflektiert wurden und die anderen Alphateilchen ungehindert die Goldfolie passieren konnten. Das Ergebnis des Experiments passte nicht zu den Ergebnissen aus Thomsons Atommodell. Also formulierte Rutherford sein eigenes Atommodell, das Kern-Hülle-Modell, bei dem ein Großteil des Atomvolumens "leer" sei. Die Masse und die positive Ladung muss also wenig Volumen haben und befindet sich im Inneren des Atoms. Außerdem besteht ein Atom aus einem Atomkern und einer Hülle, die den Kern umgibt. Während der Atomkern im Zentrum des Atoms liegt, positiv geladen ist, aus Protonen und Neutronen besteht und den Großteil der Masse besitzt, befinden sich in der Atomhülle lediglich die viel kleineren, negativ geladenen Elektronen, daher auch als Elektronenhülle bezeichnet, die dort um den Atomkern kreisen. Das Kern-Hülle-Modell ist in der folgenden Grafik nochmal veranschaulicht:
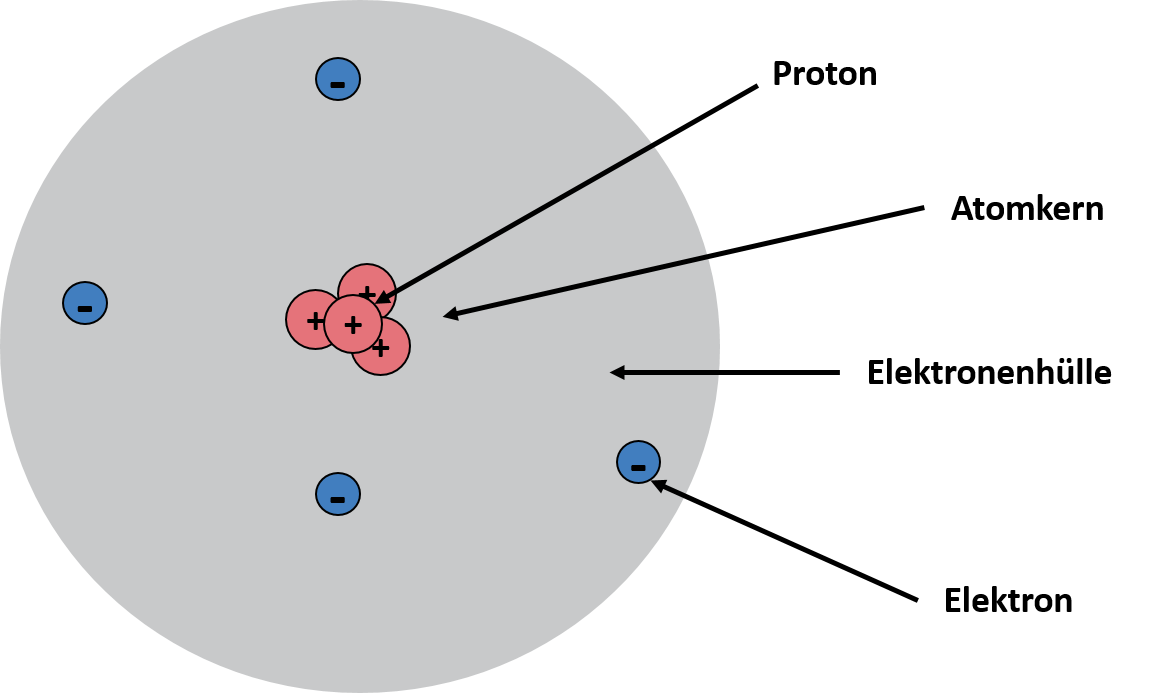
Das Kern-Hülle-Modell von Joane Dotten -
Die wichtigsten Atommodelle im Überblick (Teil 2)
Anfang des 20. Jahrhunderts erweiterte der Physiker Niels Bohr das Rutherfordsche Atommodell. Der entscheidende Unterschied ist die Beschreibung der Elektronen. Bohr erkannte den Widerspruch in Rutherfords Modell, nämlich das bewegte Ladung Energie abstrahlt. Würde man von Rutherfords Modell ausgehen, würde das bedeuten, dass die Elektronen nach dem Energieverlust in den Atomkern hineinfallen. Demnach gäbe es keine stabilen Atome. Deshalb definierte Bohr neue Annahmen: Elektronen bewegen sich mit bestimmten Energien auf einer Kreisbahn, wobei jede Kreisbahn durch einen Energiewert ausgezeichnet ist, und die Elektronen können sogar durch Energiezufuhr auf eine weiter entfernte Kreisbahn "springen". Dabei muss die Energie der Energiedifferenz der beiden Kreisbahnen entsprechen. Kehrt das Elektron auf seine ursprüngliche Kreisbahn zurück, wird die Energie in Gestalt von Strahlung abgegeben. Das Modell kannst du dir in der Grafik nochmal genauer ansehen 👇🏽👇🏽👇🏽
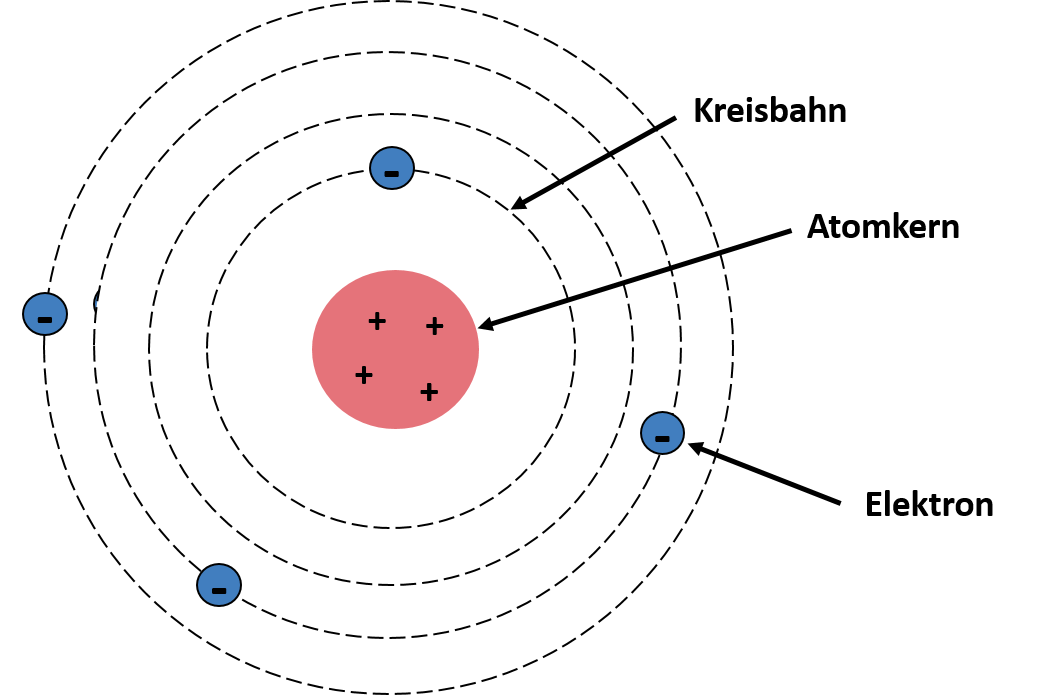
Das Bohr'sche Atommodell von Joane Dotten Das Orbitalmodell beruft sich auf die Arbeiten der Quantenmechaniker Erwin Schrödinger und Werner Heisenberger, die in den 1920er Jahren durchgeführt wurden. Das quantenmechanische Atommodell ist bis heute das aktuellste Modell zur Beschreibung der Atome. Laut diesem Modell bewegen sich Elektronen in Orbitalen, die verschiedene Arten und Formen haben können, und es lässt sich eine Aufenthaltswahrscheinlichkeit für Elektronen in den Orbitalen bestimmen. Zum Beispiel befindet sich das Elektron im Wasserstoffatom in einem kugelförmigen s-Orbital. Beispielhaft ist der allgemeine Aufbau eines Orbitals nachfolgend dargestellt:
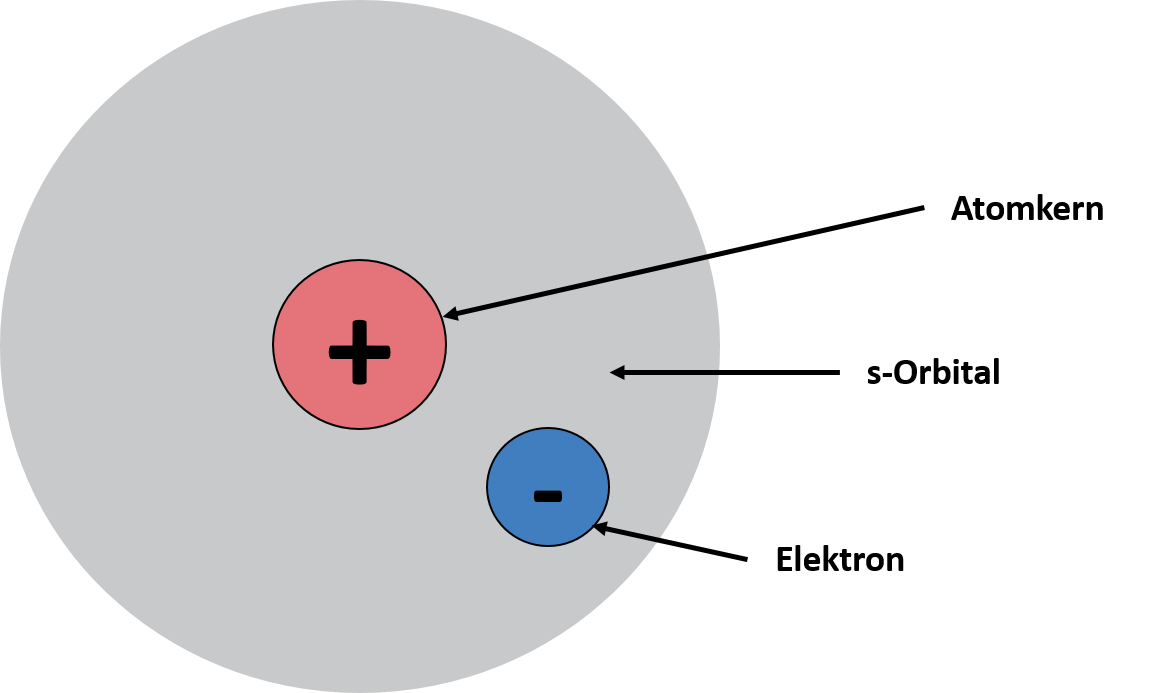
Das Orbitalmodell von Joane Dotten Das Schalenmodell hat sich sowohl das Bohrsche Atommodell als auch das Orbitalmodell zu Nutze gemacht. Demnach bewegen sich Elektronen auf kreisförmigen Schalen um den Atomkern und die Schalen weisen unterschiedliche Energien auf, weshalb jede Schale nur eine bestimmte Anzahl an Elektronen aufnehmen kann. Die Schalen haben daher auch verschiedene Bezeichnungen. Die erste bzw. innerste Schale ist die K-Schale. Dann werden die Schalen nachfolgend in alphabetischer Reihenfolge weiter benannt, also L, M, usw.. Das kannst du dir in der unteren Darstellung des Modells nochmal genauer anschauen. Außerdem wird die äußerste Schale des Atoms als Valenzschale bezeichnet, die Elektronen auf dieser Schale werden deshalb auch Valenzelektronen genannt.
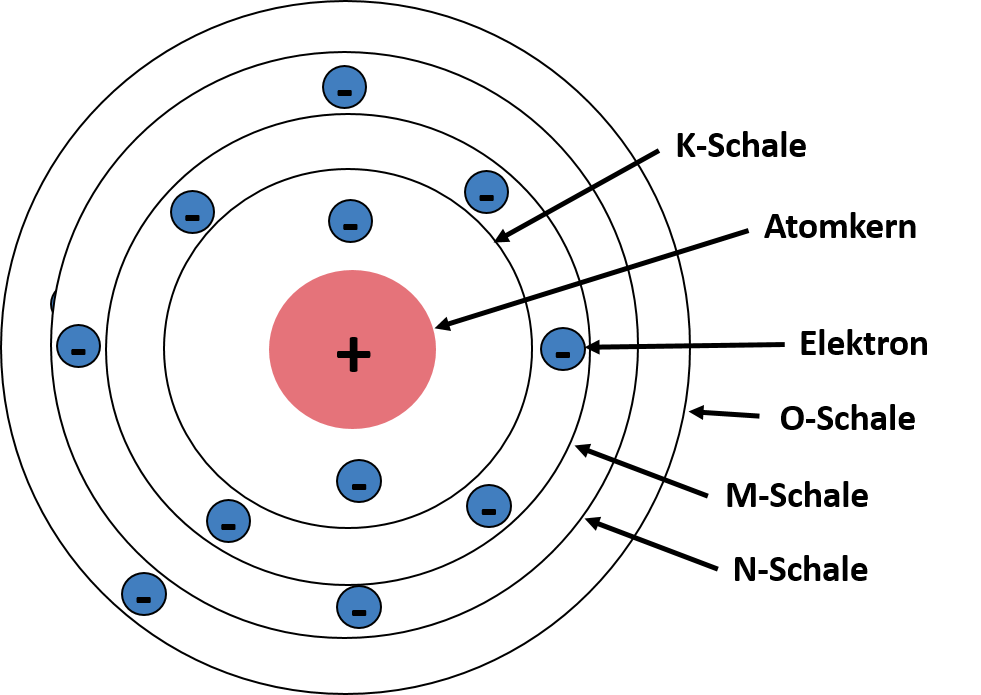
Das Schalenmodell von Joane Dotten Das Kugelmodell ist eine Erweiterung des Schalenmodells, beruft sich dabei aber eher in Richtung Orbitalmodell. Laut Kugelwolkenmodell befinden sich die Elektronen in den einzelnen Schalen in Kugelwolken bzw. kugelförmigen Elektronenwolken. Kugelwolken sind also wie die Schalen ebenfalls "Aufenthaltsraum" der Elektronen. In jeder Kugelwolke ist maximal Platz für zwei Elektronen und je weiter eine Schale vom Atomkern entfernt ist, desto mehr Kugelwolken können sich geometrisch um den Kern anordnen. Das heißt es befinden sich bei ansteigender Entfernung immer mehr Kugelwolken auf einer Schale. Das ist auch auf der schematischen Darstellung des Modells gut zu sehen ⬇⬇⬇
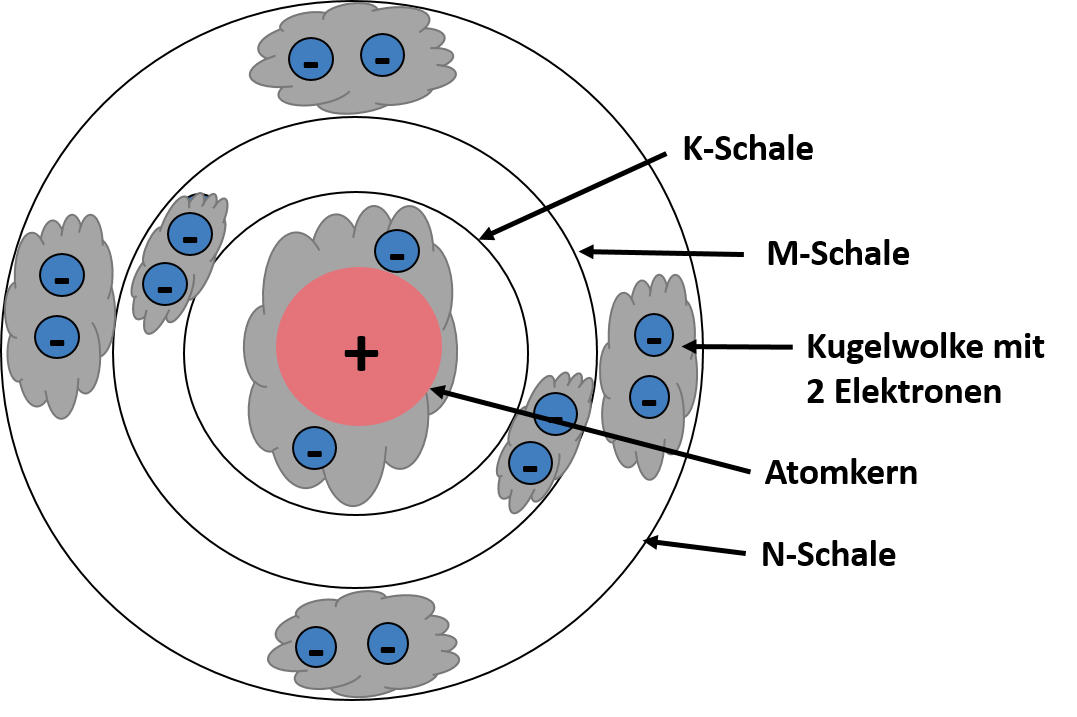
Das Kugelwolkenmodell von Joane Dotten Puh das waren ganz schön viele Atommodelle oder? 🤯 Aber keine Sorge, das Ganze sollte dir nur einen Überblick über die einzelnen Modelle geben. Erst in den nächsten Abschnitten gehen wir näher auf das Orbitalmodell und das Schalenmodell ein 😊 -
Das Schalenmodell
Wie du im vorigen Abschnitt bereits gelernt hast, bewegen sich die Elektronen auf Schalen um den Atomkern. Jede Schale kann aber nur eine bestimmte Anzahl an Elektronen aufnehmen, weshalb sie verschiedene Bezeichnungen haben. Die innerste Schale ist die K-Schale und dann geht die Benennung in alphabetischer Reihenfolge weiter. Damit du ein chemisches Element nach dem Schalenmodell darstellen kannst, musst du wissen, wie viele Elektronen die Schale aufnehmen kann. Du solltest also das sogenannte Besetzungsschema kennen. Dies kannst du ganz leicht selbst ausrechnen. Dafür brauchst du einfach nur folgende Formel:
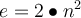 . e steht für die Anzahl der Elektronen und n für die Nummer der Schale. Die K-Schale wäre die 1. Schale, die L-Schale die 2. Schale, usw.
. e steht für die Anzahl der Elektronen und n für die Nummer der Schale. Die K-Schale wäre die 1. Schale, die L-Schale die 2. Schale, usw. Glück für dich, du musst es nicht zwingend selbst rechnen, sondern bekommst hier ganz einfach eine kleine Übersicht dazu 🤩
- K-Schale: 2 Elektronen
- L-Schale: 8 Elektronen
- M-Schale: 18 Elektronen
- N-Schale: 32 Elektronen
Das Wissen wenden wir jetzt an einem konkreten Element an: Sauerstoff. Dafür müssen wir zunächst wissen, wie viele Elektronen das Element Sauerstoff besitzt. Das ist recht easy, die Ordnungszahl eines Elements entspricht immer der Anzahl an Elektronen. Wenn wir nun ins Periodensystem nachschauen, ist die Ordnungszahl von Sauerstoff 8. Also besitzt das Element Sauerstoff 8 Elektronen. Nehmen wir uns jetzt die Übersicht oben zur Hilfe, wissen wir, dass in die K-Schale 2 Elektronen passen und in die L-Schale insgesamt 8 Elektronen. Wichtig hierbei: eine Schale muss immer voll besetzt sein, bevor ein Elektron in die nächste Schale gelangen kann. Wir haben demnach 2 Elektronen in der K-Schale und noch 6 Elektronen übrig, also besitzt die L-Schale 6 Elektronen. Das Ganze habe ich dir nochmal verbildlicht, damit du dir das besser vorstellen kannst 😊
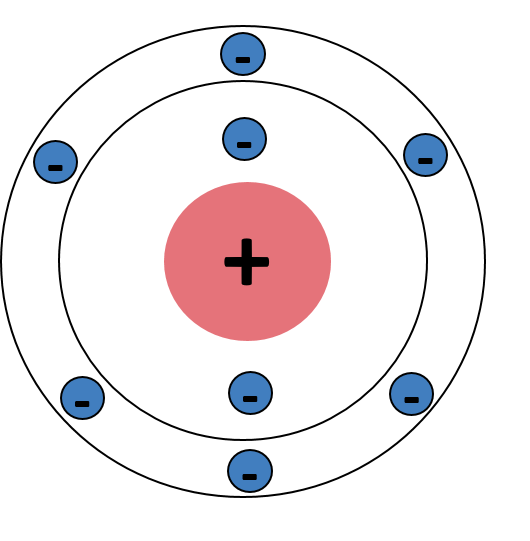
Schalenmodell des Elements Sauerstoff von Joane Dotten
Tatsächlich kommt auch mal das Schalenmodell an seine Grenzen, nach dem Element Calcium mit 20 Elektronen folgen die Nebengruppenelemente. Diese Elemente kann das Schalenmodell nicht mehr ausreichend beschreiben, also merke dir, dass das Schalenmodell bei Elementen mit über 20 Elektronen nicht mehr greift. Für die Beschreibung der Elemente solltest du dann zum Orbitalmodell wechseln ⬇⬇⬇
-
Das Orbitalmodell
Wie du bereits gelernt hast, ist das Orbitalmodell das aktuellste Modell zur Beschreibung der Atome. Laut diesem Modell bewegen sich Elektronen in Orbitalen, die verschiedene Arten und Formen haben können, und es lässt sich eine Aufenthaltswahrscheinlichkeit für Elektronen in den Orbitalen bestimmen. Orbitale sind quasi eine genauere Beschreibung der Atomhülle. Anders als im Schalenmodell bewegen sich Elektronen im Orbitalmodell ungerichtet und nicht in Kreisen um den Atomkern. Außerdem sind die Elektronen auf mehrere Orbitale verteilt. Das am einfachsten darzustellende Orbital ist eine Kugel.
Bei Orbitalen solltest du dir aber merken, dass jedes Orbital maximal nur 2 Elektronen aufnehmen kann und sie verschiedene Energien haben, genau so wie die Schalen im Schalenmodell. Darüber hinaus gibt es verschiedene Arten von Orbitalen, nämlich s-, p-, d- und f-Orbitale. Der Unterschied zwischen diesen Orbitalen ist deren Form. Jetzt wissen wir aber immer noch nicht, wie sich entscheidet welche und wie viele Orbitale ein Element besitzt. Das lässt sich mit Hilfe der Perioden im Periodensystem herausfinden. Also worauf wartest du noch? 😉
In der ersten Periode des Periodensystems befinden sich lediglich die Elemente Wasserstoff und Helium. Die Elektronenverteilung wird mittels s-Orbital bzw. 1s-Orbital (die Zahl bezieht sich auf die erste Periode) dargestellt. Das s-Orbital bei Wasserstoff ist einfach besetzt, da es nur ein Elektron besitzt, und das s-Orbital bei Helium zweifach, da Helium zwei Elektronen besitzt. Die 1s-Orbitale von Wasserstoff und Helium sind in der Abbildung nochmal für dich dargestellt 😊
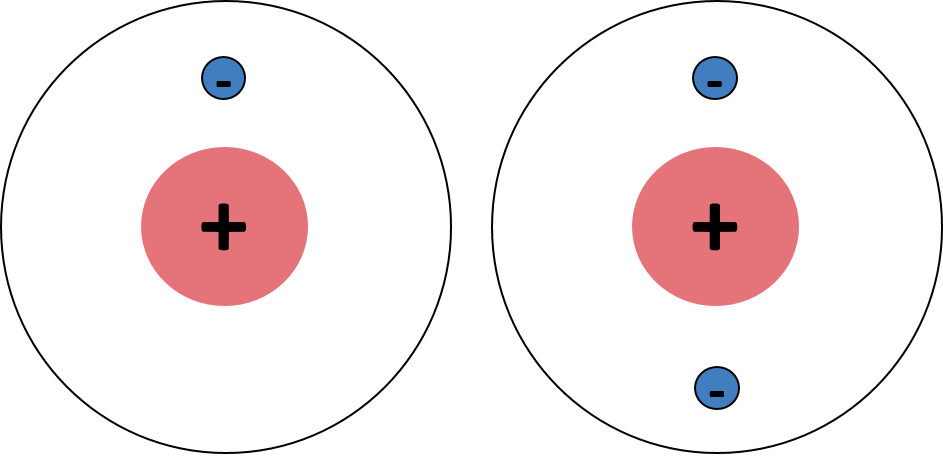
Wasserstoff und Helium nach dem Orbitalmodell von Joane Dotten Nach der ersten Periode beschäftigen wir uns natürlich mit der zweiten Periode! Daher wird das 1s-Orbital auch vom energetisch höheren 2s-Orbital abgelöst. Damit können wir aber maximal nur 4 Elektronen unterbringen. Was machen wir also mit dem Rest der Elemente in der zweiten Periode? Es folgen drei hantelförmige p-Orbitale! Da die p-Orbitale untereinander energiegleich sind, werden sie zunächst alle nur einfach besetzt (also bis zum Element Stickstoff) und danach bekommt jedes Orbital ein Elektron dazu. Das habe ich dir alles nochmal in einer Tabelle zusammengefasst:
Element
1s-Orbital
2s-Obital
2px-Orbital
2py-Orbital
2pz-Orbital
Lithium
2
1
unbesetzt
unbesetzt
unbesetzt
Beryllium
2
2
unbesetzt
unbesetzt
unbesetzt
Bor
2
2
1
unbesetzt
unbesetzt
Kohlenstoff
2
2
1
1
unbesetzt
Stickstoff
2
2
1
1
1
Sauerstoff
2
2
2
1
1
Fluor
2
2
2
2
1
Neon
2
2
2
2
2
Das gleiche Prinzip wird auch für die dritte Periode angewandt. Dabei ist es nur wichtig zu wissen, dass jetzt noch das 3s-Orbital hinzukommt. Auch das habe ich dir für die dritte Periode als Tabelle dargestellt:Element
1s-Orbital
2s-Obital
2px-Orbital
2py-Orbital
2pz-Orbital
3s-Orbital
3px-Orbital
3py-Orbital
3pz-Orbital
Natrium
2
2
2
2
1
2
unbesetzt
unbesetzt
unbesetzt
Magnesium
2
2
2
2
2
2
unbesetzt
unbesetzt
unbesetzt
Aluminium
2
2
2
2
2
2
1
unbesetzt
unbesetzt
Silicium
2
2
2
2
2
2
1
1
unbesetzt
Phosphor
2
2
2
2
2
2
1
1
1
Schwefel
2
2
2
2
2
2
2
1
1
Chlor
2
2
2
2
2
2
2
2
1
Argon
2
2
2
2
2
2
2
2
2
In der vierten Periode wird das Ganze schon ein wenig kniffliger. Auf die vorherigen Orbitale folgt das 4s-Orbital und ein d-Orbital, welches aus fünf Orbitalen besteht, die genau wie bei dem p-Orbital, untereinander energiegleich sind. Hier noch ein kleiner Hinweis: Die Reihenfolge, in der die Orbitale mit Elektronen besetzt werden, ist nicht immer die Reihenfolge der Perioden. Du startest mit dem 1s-Orbital, anschließend folgt das 2s-Orbital, die 2p-Orbitale, das 3s-Orbital und die 3p-Orbitale. Erst dann wird aus der Reihe getanzt. Erst wird das 4s-Orbital mit Elektronen besetzt und dann die 3d-Orbitale. Auch zur vierten Periode habe ich dir wieder eine Tabelle zusammen gestellt, damit die nicht ausufert, sind folgende Orbitale nicht in der Tabelle enthalten, da sie bereits vollständig besetzt sind (mit je 2 Elektronen): 1s-Orbital, 2s-Orbital, 2p-Orbitale, 3s-Orbitale und 3p-Orbitale. Außerdem werden nur die Elemente Kalium bis Eisen aus der vierten Periode dargestellt, weil sonst auch sie den Rahmen sprengen würden.Element
4s-Orbital
dxy-Obital
dyz-Orbital
dxz-Orbital
dx2-y2-Orbital
dz2-Orbital
Kalium
1
unbesetzt
unbesetzt
unbesetzt
unbesetzt
unbesetzt
Calcium
2
unbesetzt
unbesetzt
unbesetzt
unbesetzt
unbesetzt
Scandium
2
1
unbesetzt
unbesetzt
unbesetzt
unbesetzt
Titan
2
1
1
unbesetzt
unbesetzt
unbesetzt
Vanadium
2
1
1
1
unbesetzt
unbesetzt
Chrom
2
1
1
1
1
unbesetzt
Mangan
2
1
1
1
1
1
Eisen
2
2
1
1
1
1
Für die weiteren Perioden werden jeweils weitere s-, p- und d-Orbitale hinzugefügt, die f-Orbitale gibt es auch noch, kommen hingegen sehr selten vor. Wir haben uns auf die ersten vier Perioden beschränkt, damit kannst du aber bereits Vieles mittles des Orbitalmodells darstellen 😊 Das Prinzip bei den nächsten Perioden bleibt aber das Gleiche. Also keine Sorge, solltest du mal etwas aus der fünften oder sechsten Periode nach dem Orbitalmodell beschreiben müssen, ist das auch kein Problem mehr für dich 😎 -
Die Oktettregel
Der nachfolgende Link führt zu einer externen Internetseite, die ggf. andere Datenschutzvorgaben erfüllt als wir es auf dieser Plattform tun. Dabei können Daten von dir übertragen und weiterverarbeitet werden. Wenn du dich allgemein zum Thema Datenschutz erkundigen möchtest, empfehlen wir dir die Erklärvideos der Initiative Datenschutz geht zur Schule.Die Oktettregel, die auch unter dem Namen Acht-Elektronen-Regel bekannt ist, gilt für Elemente, die versuchen Verbindungen mit anderen Molekülen oder Ionen einzugehen, um acht äußere Valenzelektronen zu erreichen. Die Regel ist ein Spezialfall der Edelgasregel und mit Hilfe dieser Regel möchte das Atom nach Möglichkeit die energetisch günstigste Edelgaskonfiguration erlangen. Die Edelgaskonfiguration kann auf zwei Wegen erreicht werden. Einmal durch die vollständige Aufnahme oder Abgabe von Elektronen oder durch die Teilung der Elektronen mit anderen Atomen durch kovalente Bindungen. Es kann tatsächlich vorkommen, dass die Edelgasregel erfüllt wird, die Oktettregel aber nicht. Das trifft zum Beispiel bei Wasserstoff zu.
Valenzelektronen sind die Elektronen in der äußersten Schale bzw. im äußersten Orbital und können an Bindungen zwischen Atomen teilhaben. Die Anzahl an Valenzelektronen kannst du mit einem ganz einfachen Trick herausfinden. Sie entspricht immer der Nummer der Hauptgruppe des Elements. Bei Magnesium wären es beispielsweise zwei Valenzelektronen, da Magnesium in der zweiten Hauptgruppe steht. Einzige Ausnahme bildet hier das Element Neon in der achten Hauptgruppe. Neon besitzt insgesamt nur zwei Elektronen, die gleichzeitig auch die Valenzelektronen sind.Die Oktettregel gilt hauptsächlich für stabile Verbindungen greift im Wesentlichen ab den Hauptgruppenelementen in der zweiten Periode, wie beispielsweise Kohlenstoff, Stickstoff und Sauerstoff. Ausnahmen bestätigen aber auch hier die Regel. Du kannst dir merken, dass die Ausnahmen mit der Periode der Elemente zunehmen. Beispiele für Elemente, auf die Ausnahmen von der Oktettregel zutreffen, sind Blei und Zinn. Um die Oktettregel besser zu verstehen, wenden wir sie jetzt auf verschiedene Elemente einiger Gruppen im PSE an. Dann ist es für dich kein Problem mehr zu wissen, wann die Oktettregel greift 😎
Wir fangen mit der ersten Hauptgruppe im PSE an: den Alkalimetallen. Da du nun die Oktettregel bzw. die Acht-Elektronen-Regel anwendest und dadurch weißt, wie viele Elektronen die jeweilige Schale aufnehmen, weißt du auch, dass Lithium (3 Elektronen), Natrium (11 Elektronen) und Kalium (19 Elektronen) jeweils ein Valenzelektron in ihrer äußersten Schale haben. Denn die K-Schale kann immer noch nur 2 Elektronen aufnehmen und jede weitere Schale insgesamt 8 Elektronen. Du kannst dir das gerne nochmal in der unteren Abbildung näher anschauen.
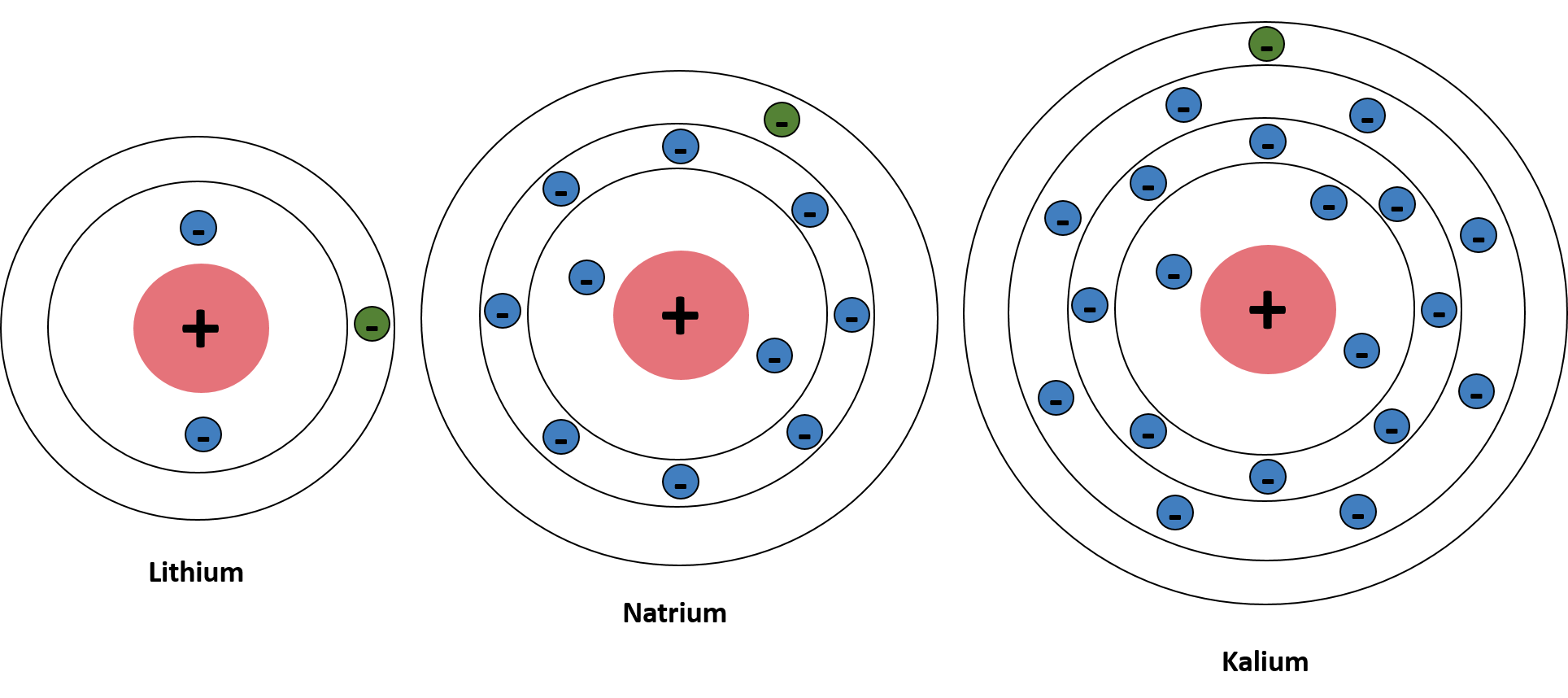
Alkalimetalle nach dem Schalenmodell von Joane Dotten Um den stabileren energetischen Zustand zu erreichen, müssen die Alkalimetalle also ihr einziges Valenzelektron abgeben. Das machen sie aber gerne, da sie eine sehr niedrige Ionisierungsenergie haben und somit sehr reaktiv sind. Die Ionisierungsenergie ist die Energie, die gebraucht wird, im ein Elektron von einem ungeladenen Atom abzuspalten. Als Folge entsteht ein Ion. Denn es gilt: je größter der Abstand des Elektrons zum Atomkern, desto schwächer ist die Bindung.
Als nächstes schauen wir uns die siebte Hauptgruppe an: die Halogene. Zu den Halogenen gehören unter anderem Chlor, Brom und Fluor. Alle Halogene haben gemeinsam, dass sie im Schalenmodell nur sieben Valenzelektronen besitzen. Das heißt wiederum, ihnen fehlt nur ein Elektron, um die Oktettregel zu erfüllen. Daher gehen sie bevorzugt Verbindungen mit den Alkalimetallen ein, da diese ja genau ein Valenzelektron frei haben. Es profitieren beide Parteien davon, da sie nun die Oktettregel erfüllen können. Auch das habe ich dir für Fluor nochmal als Abbildung aufbereitet 🖼️

Fluor nach dem Schalenmodell von Joane Dotten Auch bei den Edelgasen gibt es wieder eine Besonderheit. Wenn wir uns Neon, Argon, Xenon und die anderen Edelgase anschauen, fällt auf, dass sie in der letzten Schale acht Valenzelektronen besitzen. Sie brauchen also weder ein Elektron abgeben noch aufnehmen, da sie bereits die Oktettregel erfüllen. Daher gehen Edelgase auch kaum chemische Verbindungen mit anderen Elementen ein. Und weißt du schon, was jetzt kommt? Richtig, ein 🖼️!
So, jetzt hast du einiges über Valenzelektronen und vor allem über die Oktettregel gelernt. Das neu erlernte Wissen solltest du direkt in den Übungen auf die Probe stellen und verfestigen. Dann mal zackig jetzt! 🏃🏽♀️🏃🏽♂️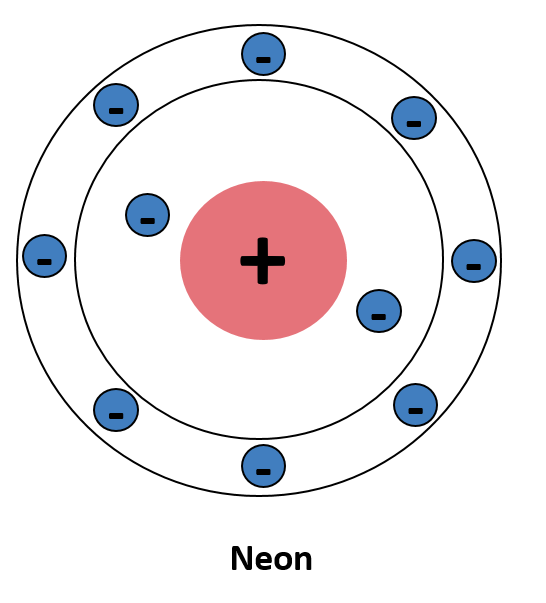
Neon nach dem Schalenmodell von Joane Dotten -
Atomare Masse
Mittlerweile wissen wir, wie Atome aufgebaut sind, aber wie viel wiegen so Atome eigentlich? Die Masse eines Atoms wird meist in der atomaren Masseneinheit u angegeben, teilweise wird sie aber auch in kg angegeben. Die Atommasse kann in relative und absolute Atommasse unterteilt werden. Aber schauen wir uns erstmal die Atommasse in u genauer an. Immerhin haben wir noch nie von der Einheit u gehört...
Wir schauen uns zunächst mal die atomare Masseneinheit u in kg an. Das ist ein bisschen greifbarer für uns:
Die Masse eines Atoms ist also wirklich wirklich klein. Außerdem entspricht die atomare Masse in kg auch in etwa der Masse von Protonen und Neutronen. Das solltest du dir auf jeden Fall merken. Die atomare Masseneinheit ist auch als ein Zwölftel der Masse des Kohlenstoffisotops 12C definiert, welches 6 Protonen und 6 Neutronen besitzt. Also entspricht ein Zwölftel der Masse des Kohlenstoffisotops 12C in etwa der Masse eines Kernteilchens (eines Protons bzw. Neutrons).
Jetzt fragst du dich sicherlich, warum es die atomare Masseneinheit in u überhaupt gibt, wenn wir auch einfach kg benutzen können 🤔 Die atomare Masseneinheit u ist tatsächlich ziemlich nützlich, da sie nah an ganzzahlige Werte der Massenzahl herankommt. Die jeweilige Massenzahl eines Elements findest du ganz einfach im PSE in der "Kachel" des Elements oben rechts. Die Massenzahl für Sauerstoff ist infolgedessen 15,999 u, kommt dem ganzzahligen Wert von 16 also ziemlich nah.
Warum die Atommasse nicht von Anfang an ein ganzzahliger Wert ist, liegt zum einen daran, dass Protonen und Neutronen nicht exakt die gleiche Masse haben und zum anderen kommen viele Elemente in der Natur als Isotopengemische vor. Dadurch kommt es zu Abweichungen, denn die Atommassen dieser Elemente hängt von der prozentualen Zusammensetzung der Isotope ab. Ein weiterer Faktor ist der Massendefekt auf. Der Massendefekt bzw. Massenverlust ist kurz gesagt der Unterschied zwischen der Summe der Massen aller Nukleonen (Protonen und Neutronen) im Atomkern und der tatsächlich gemessenen Masse des Atomkerns. Die tatsächlich gemessene Masse des Atomkerns ist geringer als die Summe der Massen aller Nukleonen.
Nun kommen wir noch zur relativen und absoluten Atommasse. Die relative Atommasse Au ist der Zahlenwert der Atommasse, also die atomare Masseneinheit ohne die Einheit u. Beim Sauerstoff wären es also nicht mehr 15,999 u, sondern einfach nur noch 15,999. Die absolute Atommasse hat jedoch eine Einheit und zwar kg (selten auch mal g). Das Element Sauerstoff hat demnach eine absolute Atommasse von
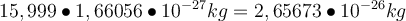 . In der Regel wirst du aber mit dem Wissen über die atomare Masseneinheit in u oder der relativen Atommasse auskommen 😊
. In der Regel wirst du aber mit dem Wissen über die atomare Masseneinheit in u oder der relativen Atommasse auskommen 😊 -
Ein Mol & seine Masse
Wie ich bereits im Modul zum PSE erklärt habe, ist Mol die Einheit der Stoffmenge und verrät dir, wie viele Teilchen der Stoff besitzt. Die Teilchen können Atome, Molküle oder Elektronen sein. Ein Mol entspricht dabei genau
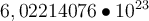 Teilchen (du darfst auch gerne auf
Teilchen (du darfst auch gerne auf 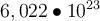 Teilchen runden). Diese Zahl wird auch die Avogadro-Zahl genannt, da gehe ich hier aber nicht weiter drauf ein, du kannst aber gerne hier mehr über die Zahl erfahren. Mit Hilfe der Avogadro-Zahl lässt sich Mol berechnen. Die Einheit der Avogadro-Konstante NA ist
Teilchen runden). Diese Zahl wird auch die Avogadro-Zahl genannt, da gehe ich hier aber nicht weiter drauf ein, du kannst aber gerne hier mehr über die Zahl erfahren. Mit Hilfe der Avogadro-Zahl lässt sich Mol berechnen. Die Einheit der Avogadro-Konstante NA ist 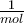 und die der Stoffmenge n ist mol. Die Formel lautet:
und die der Stoffmenge n ist mol. Die Formel lautet: 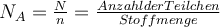
Du kannst dir jetzt selbst beantworten, wie viele Teilchen in einem Mol mit einer Stoffmenge von 1 Mol enthalten sind. Die Anzahl der Teilchen ist gleich der Avogadro-Konstante. Das prüfen wir indem wir die Formel umstellen:
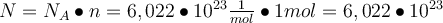 . Easy oder? 🤓
. Easy oder? 🤓Dann kommen wir jetzt mal zur molaren Masse. Wie der Name schon sagt, gibt die molare Masse an, wie schwer ein Mol eines bestimmten Stoffes ist. Die molare Masse lässt sich definieren als Masse m einer Substanz geteilt durch die Stoffmenge n derselben Substanz. Die molare Masse M wird in der Einheit
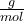 angegeben. Die Formel lautet folglich
angegeben. Die Formel lautet folglich 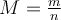 oder
oder 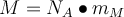 . mM ist dabei die Molekülmasse in g. Die Formel zur Berechnung der molaren Masse haben wir schonmal, dann lass uns doch direkt die molare Masse von Kohlenstoffdioxid berechnen! 👨🏽💻👩🏽💻
. mM ist dabei die Molekülmasse in g. Die Formel zur Berechnung der molaren Masse haben wir schonmal, dann lass uns doch direkt die molare Masse von Kohlenstoffdioxid berechnen! 👨🏽💻👩🏽💻- Dafür müssen wir zunächst die Indexzahl für jedes Element der Summenformel bestimmen. Die Indexzahl ist nichts anderes als die Zahl hinter dem jeweiligen Elementsymbol. Bei CO2 ist die Indexzahl für Kohlenstoff 1 und für Sauerstoff 2.
- Dann suchen wir uns für das jeweilige Element den Zahlenwert der molaren Masse aus dem PSE heraus.
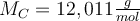 und
und 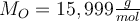
- Indem wir nun die molaren Massen der Elemente addieren, erhalten wir die molare Masse von CO2. Aber aufgepasst, du musst die Elemente mit ihren vorher bestimmten Indexzahlen multiplizieren❗❕
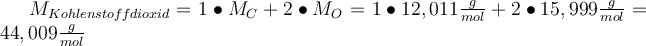 . Die molare Masse von Kohlenstoffdioxid ist also in etwa 44
. Die molare Masse von Kohlenstoffdioxid ist also in etwa 44 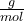 .
.
Wenn du nur die molare Masse eines einzelnen Elements bzw. Atoms wissen willst, kannst du ganz einfach die Massenzahl aus dem PSE ablesen. Zwar ist das die Atommasse in der atomaren Masseneinheit u, du kannst sie aber ganz leicht mit der Avogadro-Konstanten in die molare Masse umrechnen. Dabei wirst du feststellen, dass der Wert der molaren Masse dem Wert der Atommasse entspricht. Das heißt du kannst dir den kompletten Schritt sparen und die molare Masse direkt aus dem PSE ablesen. JUHU!!! Du glaubst mir nicht? Hier der Beweis: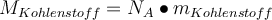
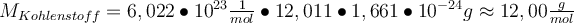
-
Isotope
Das ein oder andere Mal hast du hier im Kurs bereits den Begriff Isotop gelesen. Genau darauf möchte ich in diesem Abschnitt näher eingehen. Isotope sind Atome eines Elements, welche die gleiche Anzahl an Elektronen und Protonen haben, jedoch eine andere Anzahl an Neutronen. Die unterschiedliche Anzahl an Neutronen führt zu einer abweichenden Atommasse. Isotope haben demnach die gleiche Ordnungszahl, weswegen sich der Begriff Isotop immer auf ein spezielles Element bezieht. Erhöhst du also die Anzahl der Neutronen, wird im Gegenzug die Atommasse größer und bleibt im Gegenzug die Anzahl an Elektronen und Protonen unverändert, wird das als Isotop bezeichnet. Isotope lassen sich in langlebige, stabile und kurzlebige, instabile Isotope unterteilen.
Tatsächlich verrät der Begriff Isotop uns bereits etwas. Er setzt sich aus den altgriechischen Wörtern "isos" und "tropos" zusammen, die übersetzt "gleich" und "Stelle" ergeben. Tatsächlich findet man die Isotope im PSE immer an der selben Stelle, Isotope haben nämlich dieselbe Ordnungszahl bzw. Kernladungszahl und gehören folglich zum gleichen Element. Achte aber darauf Isotope und Nuklide nicht miteinander zu verwechseln. Nuklide sind eine bestimmte Atomart, die durch die Ordnungszahl und die Kernladungszahl definiert ist. Beispielsweise ist ein Nuklid ein Atom mit einer Massenzahl von 16 und einer Ordnungszahl von 8. Ein Isotop bezieht sich hingegen auf ein spezielles Element, sprichst du zum Beispiel von einem Isotop des Elements Stickstoff, beziehst du dich nicht auf ein spezielles Atom, sondern beschreibst zwei mögliche Atome des Elements Stickstoff.
Gucken wir uns ein weiteres Beispiel für ein Isotop an. Ein Atom des Elements Kohlenstoff hat immer sechs Protonen im Kern (das sagt uns die Ordnungszahl) und genauso viele Elektronen in der Schale. Nur die Anzahl an Neutronen kann variieren. Dann wird von Kohlenstoffisotopen gesprochen. Vielleicht ein kleiner Merksatz dazu, den ich dazu gefunden habe und ganz passend fand: Du kannst dir zwei Isotope wie Zwillinge vorstellen, von denen der eine ein bisschen mehr Gewicht hat 😊
Wie ich bereits gesagt habe, lassen sich Isotope in stabil und instabil einteilen. Instabile Isotope sind vom Zerfall des Atomkerns gekennzeichnet, was radioaktive Strahlung zur Folge hat. Daher werden instabile Isotope auch als radioaktive Isotope bezeichnet. Die radioaktiven Isotope zerfallen dann zu den oben genannten Nukliden. Stabile Isotope zerfallen dagegen nicht und sind auch nicht radioaktiv. Es gibt noch eine weitere Unterscheidungsart und zwar die Anzahl der Isotope. Reinelemente sind die Elemente, die nur über ein einziges natürlich vorkommendes Isotop verfügen, während Mischelemente bzw. Isotopengemische mehrere Isotope beinhalten. Das Atomgewicht eines Mischelements setzt sich aus dem Atomgewicht der einzelnen Isotope zusammen, dabei muss aber auf die relative Häufigkeit der Isotope geachtet werden. Ein Beispiel für ein Reinelement ist Natrium mit 11 Protonen und 12 Neutronen und ein Beispiel für ein Mischelement ist Zinn mit insgesamt 10 Isotopen.
So, aber wie finde ich jetzt heraus, ob und wie viele Isotope ein Element besitzt? Das ist gar nicht so schwer, du brauchst lediglich die Ordnungszahl und die Massenzahl. Oben links im PSE ist die Ordnungszahl zu finden und sagt dir, wie viele Protonen das Element besitzt. Nehmen wir jetzt als Beispiel das Element Kohlenstoff, können wir daraus 6 Protonen ableiten. Da Protonen und Neutronen in etwa die gleiche Masse haben, lässt sich auch die Anzahl an Neutronen ablesen. Die Massenzahl zählt nämlich Protonen und Neutronen zusammen. Im Falle eines Kohlenstoffes, der kein Isotop ist, ist diese in etwa 12. Da wir bereits durch die Ordnungszahl wissen, dass Kohlenstoff 6 Protonen besitzt, müssen wir nur die Ordnungszahl von der Massenzahl subtrahieren und haben als Ergebnis 6 Neutronen.
Isotope haben auch ihre eigene Schreibweise, die sich auf die Massenzahl bezieht. Und zwar wird diese hochgestellt vor dem Elementsymbol geschrieben. Teilweise wird auch die Kernladungszahl (= die Ordnungszahl) mit angegeben, die wird ebenfalls vor das Elementsymbol geschrieben, nur eben tiefgestellt. Sauerstoff-16, und Sauerstoff-17 wird nach dieser Technik also wie folgt angegeben: